Lexikon der Biologie: G-Proteine
G-Proteine, Guaninnucleotid-bindende Proteine, GTP-Bindungsproteine, GTP-bindende Proteine, große Superfamilie von Proteinen, welche die Fähigkeiten besitzen, GTP (Guanosin-5'-triphosphat) zu binden und dessen Hydrolyse in GDP (Guanosin-5'-diphosphat) und Pi (anorganisches Phosphat) zu katalysieren. Durch diesen Vorgang wird ein „Ein-Aus-Schaltungs“-Mechanismus für jeweils bestimmte Zellaktivitäten in Gang gesetzt. G-Proteine fungieren als Vermittler (Transducer) in der Signaltransduktion, die zwischen verschiedenen Rezeptoren (G-Protein gekoppelte Rezeptoren), die extrazelluläre Reize perzipieren, und den an diese Signalwege gekoppelten Effektoren, welche die Antwort in die Zelle weiterleiten, wirken ( vgl. Abb. ). Die G-Protein-Superfamilie kann in folgende verschiedene Familien unterteilt werden: 1) Translationsfaktoren, die an der ribosomalen Proteinsynthese (Translation) beteiligt sind, z.B. EF-Tu; 2) die heterotrimeren G-Proteine (G-Proteine i.e.S.), die das transmembrane Signal von Hormonen und Licht übertragen ( vgl. Abb. ); 3) die Ras-Proteine, die bei der Regulation der Zellproliferation und -differenzierung eine Rolle spielen; 4) andere kleine (relative Molekülmasse 20.000-35.000) GTPasen, die vermutlich in der Regulation des intrazellulären Transports von Vesikeln (z.B. Rab, ARF; Guanosintriphosphatasen) und bei der Aktivierung von Bewegungsvorgängen (Bewegung) und der Organisation des Cytoskeletts (Zellskelett) involviert sind; 5) solche, die an der Bindung der naszierenden Polypeptidkette an das endoplasmatische Reticulum (ER) beteiligt sind (z.B. SRP, SRP-R; docking protein). In der Superfamilie der GTP-bindenden Proteine sind jene Proteine nicht eingeschlossen, die zwar GTP binden, dieses aber nicht als „Ein-Aus-Schalter“ verwenden, wie z.B. Tubulin, Guanylat-Cyclase und GTP-bindende Kinasen.
Alle GTP-bindenden Proteine durchlaufen den gleichen „Ein-Aus-Schaltungs“-Zyklus, der 2 verschiedene Konformationszustände beinhaltet – abhängig davon, ob GTP oder GDP an das Protein gebunden ist. Das G-Protein mit gebundenem GTP stellt die aktive, mit gebundenem GDP die inaktive Konformation dar. Die Umwandlung vollzieht sich durch Austausch von GDP durch GTP und wird durch einen Guaninnucleotid-Austauschfaktor (engl. guanine nucleotide exchange factor, GEF; guanine nucleotid exchange factor) stimuliert. Dieser löst durch seine Bindung an Protein/GDP eine Konformationsänderung eines Effektors (z.B. eines Enzyms) aus, wodurch die Affinität der Nucleotidbindungsstelle für GDP erniedrigt und für GTP erhöht wird. GTP, dessen intrazelluläre Konzentration höher ist als die von GDP, bindet an das Protein, sobald GDP abdissoziiert. Die Überführung von G-Protein/GTP in Protein/GDP vollzieht sich aufgrund der intrinsischen GTPase-Aktivität des Proteins, die durch die Bindung eines GTPase-aktivierenden Proteins (GAP; GTPase-aktivierende Proteine) an Protein/GTP sehr stark angeregt wird. Die Natur von GEF und GAP hängt von der GTPase ab.
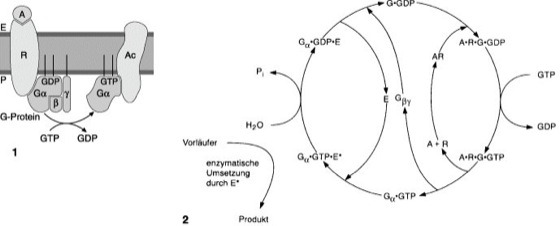
Die G-Proteine i.e.S. sind membrangebundene Heterotrimere, die aus je einer α- (relative Molekülmasse 39.000–52.000), β- (35.000–36.000) und γ-Untereinheit (7000–10.000) bestehen. Die α-Untereinheit trägt in der Regel einen N-terminalen Myristinsäurerest und einen Palmitinsäurerest an Cys-3, die γ-Untereinheit einen Farnesyl- oder Geranosylrest. Mit diesen 3 hydrophoben Ketten ist der Komplex P-seitig in der Membran verankert. Die Untereinheiten liegen in verschiedenen Isoformen vor. Man unterscheidet derzeit 16 verschiedene α-Untereinheiten, 5 β- und 12 γ-Untereinheiten. Die α-Untereinheiten unterscheiden sich zwischen den verschiedenen G-Protein-Spezies, während die β- und γ-Untereinheiten austauschbar zu sein scheinen. Dabei können sich anscheinend in vivo nicht alle denkbaren Kombinationen ergeben. β- und γ-Untereinheit sind so fest miteinander verbunden, daß sie in vitro nur durch Denaturierungsmittel getrennt werden können und in vivo als eine dimere Einheit fungieren. Jede α-Untereinheit scheint aus 2 Domänen zu bestehen, einer mit ca. 170 Aminosäureresten, die eine einzige Guaninnucleotidbindungsstelle (GDP oder GTP) mit hoher Affinität und niedriger intrinsischer GTPase-Aktivität enthält, und einer mit ca. 130 Aminosäureresten, die wie ein eingebautes GAP wirkt, wenn die α-Untereinheit ihr Effektorprotein bindet und die geeignete Konformation einnimmt. Die α-Untereinheiten, die eine GTPase-Aktivität für die Hydrolyse von gebundenem GTP besitzen, können die Adenylat-Cyclase aktivieren (Gs) oder inhibieren (Gi, Gzα), Ionenkanäle öffnen oder schließen (Kaliumkanäle bzw. spannungsabhängige Calciumkanäle; Goα, Giα), die Phospholipase C aktivieren (Giα, Gqα), Phospholipase A2 modulieren (Giα, Goα) oder Phosphodiesterase aktivieren (Gtα, Ggustα). Die β/γ-Dimere beeinflussen die Adenylat-Cyclase, Phospholipase Cβ, Phospholipase A2 und die Phosphatidylinositol-3-Kinase. Am besten untersucht ist die Rolle der G-Proteine an den Systemen, bei denen über β-adrenerge Rezeptoren die Adenylat-Cyclase reguliert wird oder über Rhodopsin eine Hyperpolarisation der Plasmamembran bewirkt wird. Im Fall der β-adrenergen Rezeptoren existieren sowohl G-Proteine, welche die Adenylat-Cyclase stimulieren (Gs), als auch solche, die das Enzym inhibieren (Gi). Die Signaltransduktion beginnt mit der Besetzung des Rezeptors durch Liganden. Am Beispiel von Gs ergibt sich folgender Wirkmechanismus ( vgl. Abb. ): Der Hormon-Rezeptor-Komplex stimuliert die Dissoziation des Gs-GDP und die Bildung von Gs-GTP, wobei für diesen Austausch β- und γ-Untereinheiten notwendig sind, die dann von der α-Untereinheit (Gsα) abdissoziieren. Dabei wird der aktive Gsα-GTP-Komplex freigesetzt, der dann die Adenylat-Cyclase stimuliert (Gsα-GTP-E*), bis die GTPase-Aktivität das Signal wieder abschaltet (Gsα-GDP-E), worauf Enzym und G-GDP wieder dissoziieren und damit für einen neuen Zyklus zur Verfügung stehen. Die α-Untereinheit in der GDP-Form komplexiert wieder mit dem β/γ-Dimer, wodurch auch dessen Einfluß auf das Enzym beendet ist. Bei diesem Mechanismus kommt es zu einer Signalamplifikation, da ein Hormon-Rezeptor-Komplex mit ca. 10 Molekülen Gs interagieren kann und ein Molekül Adenylat-Cyclase Hunderte von Molekülen cAMP herstellen kann. Gs und Gi sind auch Angriffspunkte von Bakterientoxinen. So wirkt Choleratoxin durch ADP-Ribosylierung von GS inhibierend auf die GTPase-Aktivität, während Pertussistoxin vorwiegend durch ADP-Ribosylierung von Gi die Interaktion von G-Protein und Rezeptor stört, was beides zu einer Überfunktion der Adenylat-Cyclase führt. Ging man zunächst davon aus, daß G-Proteine ausschließlich in der Plasmamembran vorkommen, weiß man seit einiger Zeit, daß es sie auch in sekretorischen Vesikeln innerhalb der Zelle gibt. Dort beeinflussen sie offenbar die Aufnahme von Hormonen und Neurotransmittern. Insgesamt ergibt sich ein vielfältiges Bild der heterotrimeren G-Proteine: manche Rezeptoren agieren nur mit einem Typ des G-Proteins, manche mit mehreren; manche Zellen exprimieren mehrere Rezeptoren, die mit unterschiedlichen G-Proteinen zusammenarbeiten; verschiedene Isoformen von Effektoren können mit G-Proteinen unterschiedlich reagieren.
Die Familie der ras-Onkogene codiert für eine Gruppe von Proteinen (p21), die den G-Proteinen ähnlich sind. Diese monomeren Ras-Proteine sowie verwandte monomere Proteine werden heute aufgrund ihrer Funktion als regulierende GTPasen bzw. Guanosintriphosphatasen auch den G-Proteinen i.w.S. zugeordnet. cAMP-Kaskade, Gilman (A.G.), G-Protein gekoppelte Rezeptoren, Gustducin, Insulinrezeptor, Ionenkanäle, Photorezeption, Rodbell (M.).
K.G./S.Kl.
G-Proteine
1 Schema der Wirkungsweise heterotrimerer G-Proteine. Nach Bindung eines Agonisten, z.B. Adrenalin (A), auf der extraplasmatischen Seite (E) der Membran an den Rezeptor (R) interagiert dieser auf der plasmatischen Seite (P) mit einem heterotrimeren G-Protein, dessen α-Untereinheit GDP gebunden hat. Im folgenden wird in der α-Untereinheit GDP durch GTP ersetzt, woraufhin das G-Protein vom Rezeptor und das stabile β/γ-Dimer von der α-Untereinheit abdissoziiert. Sowohl die α-Untereinheit mit gebundenem GTP als auch das β/γ-Dimer (hier nicht gezeigt) können mit Effektoren, im Falle der α-Untereinheit z.B. der Adenylat-Cyclase (AC), in Wechselwirkung treten und damit die Weiterleitung eines Signals vermitteln. Die Beendigung dieser Wechselwirkung wird durch die GTPase-Aktivität der α-Untereinheit eingeleitet. Infolge der GTP-Hydrolyse dissoziiert die α-Untereinheit vom Effektor ab und vermag wieder das β/γ-Dimer zu binden. Das wiederhergestellte heterotrimere G-Protein kann erneut an einen Rezeptor assoziieren.
2 Interaktionen und Zwischenstufen bei der Rezeptor-(R)-gesteuerten Aktivierung eines Effektors (E→E*) über die α-Untereinheit heterotrimerer G-Proteine (G) nach Bindung eines Agonisten (A). Neben der GTP-aktivierten α-Untereinheit kann auch das β/γ-Dimer mit einem Effektor wechselwirken.
Schreiben Sie uns!