Lexikon der Biochemie: Proteine
Proteine, Eiweißstoffe, ausschließlich oder überwiegend aus Aminosäuren aufgebaute makromolekulare Verbindungen, die als Biopolymere entscheidender Bestandteil der lebenden Materie sind. In einer Escherichia-coli-Zelle sind 3.000 verschiedene P. enthalten, mehr als 100.000 unterschiedliche P. finden sich im menschlichen Organismus. P. bestimmen Struktur und Funktion jeder Zelle.
1) Als Enzyme und Peptidhormone sind sie für den geregelten Ablauf der chemischen Reaktionen des Stoffwechsels verantwortlich. Enzyme katalysieren die zahllosen biochemischen Reaktionen, die den Stoffwechsel der lebenden Zellen ausmachen. Diese Reaktionen werden durch Modifikation der Aktivität und/oder Menge (d.h. Synthesegeschwindigkeit) der geeigneten Enzyme reguliert. Einige der Regulatoren und Reaktionsübermittler dieses Regulationsprozesses sind ebenfalls P., z.B. die Peptidhormone, Repressor- und Aktivatormoleküle (Genaktivierung, Operon) und die Membranproteine, die die intrazellulären Konzentrationen vieler Enzymsubstrate und Produkte bestimmen (aktiver Transport). 2) Als Strukturproteine (Gerüstproteine, Scleroproteine), z.B. Kollagene, Elastine, Keratine, sind sie wesentlicher Bestandteil von Stützgewebe, Bindegewebe und Biomembranen. 3) Als kontraktile P., z.B. Actin und Myosin, ermöglichen sie den Kontraktionsprozess der Muskelfaser. 4) Als Immunglobuline oder Interferone bilden sie spezifische körpereigene Abwehrproteine. 5) Als Trägerproteine, z.B. Hämoglobin, Serumalbumin sowie Cytochrome, Transferrin, Coeruloplasmin, sind sie am Transport von Sauerstoff, Fettsäuren, Hormonen, Medikamenten, Stoffwechselprodukten und Metall-Ionen sowie an Elektronenübertragungsprozessen der Photosynthese und Atmung beteiligt. 6) Als Speicherproteine, z.B. Eialbumine, Milchcasein, Gliadin (in Weizensamen) und Zein (in Maissamen) sichern sie die Aminosäurereserve des Organismus. 7) Als Rezeptorproteine vermitteln sie die spezifische Bindung von Wirkstoffmolekülen am Wirkort. 8) Als Zellerkennungsproteine werden sie auf Zelloberflächen präsentiert, ermöglichen so die Erkennung eines Zelltyps durch einen anderen und spielen deshalb eine Rolle bei der Morphogenese und der Erkennung von fremdem Gewebe (wie bei der Transplantatabstoßung). Darüber hinaus sind P. beim Blutgerinnungsprozess, bei der Blutgruppenspezifizierung, bei der Steuerung der Genaktivitäten und bei der Regulation vieler anderer biochemischer Prozesse von entscheidender Bedeutung.
Theoretisch ist die Länge einer Polypeptidkette nicht begrenzt und sind alle Permutationen und Kombinationen der 20 aufbauenden Aminosäuren möglich (genetischer Code). Weitere Möglichkeiten zur strukturellen Variation bieten die Posttranslationsmodifizierung, die Anheftung von prosthetischen Nichtprotein-Gruppen und die Ausbildung von Quartärstrukturen in unterschiedlichem Grad, so dass die mögliche Strukturvielfalt (und damit verbunden die Funktionsvielfalt) beinahe unbegrenzt ist.
P. sind in Lösung weder starr noch bewegungslos. Die Bindungen zwischen den Kohlenstoffatomen im Proteinrückgrat und in den Aminosäureseitenketten ermöglichen eine beträchtliche Rotations- und Torsionsflexibilität, weshalb die thermischen Bewegungen der einzelnen Atome Verwindungsbewegungen der Ketten erzeugen. Diese Bewegungen sind höchstwahrscheinlich für die enzymatische Aktivität von P. von Bedeutung. Mutationen, die die Flexibilität der Kette beeinträchtigen, wirken sich vermutlich auch auf die Kinetik der Enzymkatalyse aus. (Allosterie) [R.H. Pain Nature 305 (1983) 581-582]
Einteilung. Auf Unterschieden in der Löslichkeit und in der Molekülstruktur beruht die Einteilung in globuläre P. und fibrilläre P. Die globulären P. (Sphäroproteine) sind in Wasser und verd. Salzlösungen löslich. Sie sind kugelförmig gebaut (Rotationsellipsoide). Die definierte Faltung der Sekundärstrukturelemente der Polypeptidketten beruht im wesentlichen auf hydrophoben Wechselwirkungen zwischen unpolaren Aminosäureseitenketten und anderen nichtkovalenten Bindungen. Die gute Löslichkeit beruht auf den an der Moleküloberfläche lokalisierten, geladenen, hydrophilen Aminosäureresten, die – umgeben von einer Hydrathülle – für einen engen Kontakt mit dem Lösungsmittel sorgen. Zu den globulären P. gehören alle Enzyme und die meisten anderen biologisch aktiven P., z.B. die Hämoglobine. Die fibrillären P. (Linearproteine, Faserproteine) sind praktisch in Wasser und Salzlösungen unlöslich. Die Polypeptidketten sind hier parallel zueinander geordnet und bilden in Form langer Fasern unter anderem die Strukturelemente des Bindegewebes. Wichtige Vertreter sind die Kollagene, Keratine und Elastine. Nach den Bestandteilen unterscheidet man einfache P., die nur aus proteinogenen Aminosäuren aufgebaut sind, und zusammengesetzte P. bzw. konjugierte P., die neben dem Proteinanteil eine meist chemisch gebundene Nichtproteinkomponente enthalten. Einfache P. sind die Albumine, Globine, Globuline, Gluteline, Histone, Prolamine, Protamine, die sämtlich globuläre P. sind, und die fibrillären Scleroproteine.
Aufbau und Struktur. Am Aufbau der P. sind 20 unterschiedliche Aminosäuren (auch proteinogene Aminosäuren genannt) beteiligt. Sie sind durch Peptidbindungen miteinander verknüpft, wobei die Reihenfolge (Sequenz) der Bausteine genetisch determiniert ist.
Zur Charakterisierung des strukturellen Aufbaus der P. wurden die auch für andere Biopolymere gültigen Bezeichnungen Primär-, Sekundär-, Tertiär-, Quartärstruktur eingeführt. Unter Primärstruktur versteht man die Anzahl und Sequenz der miteinander verknüpften Aminosäurebausteine, die durch Sequenzanalyse (Edman-Abbau) ermittelt werden können. P. enthalten in der Regel mehr als 100 Aminosäuren in einer Polypeptidkette.
Unter Sekundärstruktur wird die Art und Weise der Kettenfaltung verstanden, die durch Ausbildung von Wasserstoffbrücken (H-Brücken) zwischen dem Sauerstoff der Carbonylgruppe und dem Wasserstoff der Amidgruppe gegenüberliegender Peptidbindungen (Abstand 0,28nm) zustande kommen. Bilden sich die H-Brücken innerhalb einer Peptidkette aus, kommt es zur Schraubenstruktur (Helix), liegen intermolekulare H-Brücken vor, so entsteht die Faltblattstruktur (β-Struktur; Abb. 1b). Die häufigste helicale Struktur ist die α-Helix mit 3,6 Aminosäureresten je Windung (Abb. 1a).
Der prozentuale Anteil an α-helicalen Strukturen in einem P. kann durch Messung der optischen Rotationsdispersion (ORD) und des Circulardichroismus (CD) bestimmt werden, weil die Helices selbst optisch aktiv sind. Die langsame Austauschgeschwindigkeit von Proteinwasserstoffatomen mit Deuteriumoxid oder Tritiumoxid ist umgekehrt proportional zur Anzahl der intramolekularen Wasserstoffbrückenbindungen. Die Bestimmung der α-Helixstruktur mit Hilfe dieser Methode weicht allerdings von den Ergebnissen der optischen Methode oftmals ab. Die Röntgenstrukturanalyse, die zur Bestimmung der Tertiärstruktur herangezogen wird, liefert auch detaillierte Informationen über die Sekundärstruktur.
Unter Tertiärstruktur versteht man die räumliche Anordnung der als α-, β- oder Zufallsknäuel-Struktur vorliegenden Abschnitte einer Polypeptidkette. Die Tertiärstruktur liefert nicht nur Angaben über die Molekülgestalt, sondern auch detaillierte Angaben über die räumliche Anordnung reaktiver Aminosäurereste, z.B. im aktiven Zentrum von Enzymen (Abb. 2) oder im Antigenbindungsort von Antikörpern. Mit ihrer Hilfe wurden erstmals Enzym-Substrat- und Enzym-Inhibitor-Komplexe und die dabei stattfindenden Gestaltsveränderungen des Enzymmoleküls bis zu einer Auflösung von 0,2nm sichtbar gemacht. Hierzu dient die Röntgenstrukturanalyse isomorph kristallisierter Schwermetallatomderivate des betreffenden Proteins. Die erhaltenen Beugungsdiagramme und daraus konstruierten Elektronendichteverteilungskarten geben Aufschluss über die Art und Lage der Aminosäurereste und bei hoher Auflösung (0,15nm) sogar über die Atomabstände im Proteinmolekül.
Am Zustandekommen und an der Stabilisierung der dreidimensionalen Proteinstruktur sind außer den von der Sekundärstruktur her bekannten H-Brücken (zwischen Tyrosyl- und Carboxyl- bzw. Imidazolgruppen sowie Seryl- und Threonylresten) und den Disulfidbrücken, denen vor allem eine konformationsstabilisierende Wirkung zugesprochen wird, noch folgende Wechselwirkungen beteiligt: Van-der-Waalssche Kräfte, Anziehungskräfte zwischen den nicht kovalent verbundenen ungeladenen (-CH3, -CH2OH) oder hydrophoben (Phenyl-, Leucyl-) Resten im Abstand von etwa 0,3nm, elektrostatische Wechselwirkungen zwischen polaren Seitengruppen (z.B. COO-... +NH3), die eine Solvatation des Moleküls ermöglichen, und Lösungsmittel-P.-Wechselwirkungen. Letztere sind für die natürliche Konformation der P. von Bedeutung. Sie bestehen vorwiegend in der Ausbildung hydrophober Bindungen (Atomabstand 0,31-0,41nm) besonders im unpolaren Molekülinneren, aber auch zum umgebenden Lösungsmittel.
Die Sekundär- und Tertiärstruktur werden gemeinsam auch als Kettenkonformation bezeichnet. Es ist manchmal schwierig, eine klare Unterscheidung zwischen Sekundär- und Tertiärstruktur zu treffen. NMR-Untersuchungen zeigen, dass sich die Kettenkonformation eines Proteins innerhalb bestimmter Grenzen verändern kann, so dass die durch Röntgenstrukturanalyse bestimmte Konformation eine von mehreren möglichen Zuständen darstellt, der durch Kristallisation "eingefroren" wurde.
Durch Ausbildung intermolekularer Wechselwirkungen (nichtkovalenter Natur) zwischen zwei oder mehreren identischen oder verschiedenen Polypeptidketten aggregieren oder assoziieren letztere zu stabilen oligomeren P. Diese geordneten Assoziate stellen die Quartärstruktur und ihre Polypeptidketten die Untereinheiten eines Proteins dar (Abb. 3). In seltenen Fällen sind auch Disulfidbrücken zur Aufrechterhaltung der Quartärstruktur nötig. P. mit Quartärstruktur sind weit verbreitet. Der überwiegende Teil quartärer P. ist aus nichtkovalent verbundenen Untereinheiten aufgebaut. Ein Vergleich der Zahl und Größe der Untereinheiten in den bekannten Mehrkettenproteinen ergibt ein deutliches Überwiegen der aus zwei und aus vier Untereinheiten bestehenden P. Dagegen ist das Vorkommen von P. mit einer ungeraden Zahl oder unterschiedlich großen Untereinheiten oder mit Untereinheiten, die unabhängig voneinander aktiv sind, sowie mit regulatorischen und katalytischen Untereinheiten weitaus seltener anzutreffen. Offensichtlich sind die P. mit Quartärstruktur hinsichtlich der Flexibilität ihrer Gestalt und Aktivität physiologischen Erfordernissen am besten angepasst. Ihre monomeren Formen sind meist inaktiv. Der Nachweis einer Quartärstruktur erfolgt entweder nach vorhergehender Dissoziation des Aggregats in seine Untereinheiten durch Ultrazentrifugation, Polyacrylamid-Diskelektrophorese, Gelfiltration, Ionenaustauschchromatographie, Viskosimetrie u.a. oder am intakten Molekülaggregat durch Elektronenmikroskopie oder durch Röntgen- bzw. Neutronenstrukturanalyse. Zur Dissoziation dienen Natriumdodecylsulfat (1%ig), 8M Harnstofflösung, 6M Guanidin-HCl-Lösung, pH-, Temperatur- oder Proteinkonzentrationsveränderungen sowie chemische Modifizierungen (Succinylierung, Maleinierung, Entfernung oder Bindung von Cofaktoren). NMR-Spektroskopie, Röntgenstrukturanalyse.
Eigenschaften. Alle P. haben eine hohe relative Molekülmasse Mr, die unter anderem durch Bestimmung der Diffusions- und Sedimentationsgeschwindigkeit in der Ultrazentrifuge, durch Messung der Licht- und Röntgenkleinwinkelstreuung, durch osmotische und elektrophoretische Messungen sowie durch Bestimmung der Wanderungsgeschwindigkeit in Dextran- oder Polyacrylamidgelen ermittelt werden kann. Die Mr der Einkettenproteine liegen zwischen 10 kDa und 100 kDa, die der Mehrkettenproteine im Bereich von etwa 50 kDa bis zu mehreren Millionen kDa.
Entsprechend ihrer Molekülgröße und -gestalt (Abmessungen zwischen 2 und 100 nm) gehören die P. zu den Kolloiden. Sie dialysieren nicht, bilden keine echten Lösungen, zeigen den Tyndall-Effekt und weisen eine relativ hohe Viskosität auf. Infolge der großen Anzahl ionisierter Gruppen im Molekül haben die P. hohe Dipolmomente. Besonders charakteristisch ist die Ampholytnatur der P. Sie beruht auf der gleichzeitigen Anwesenheit freier saurer und basischer Gruppen im Proteinmolekül. Der Ladungszustand des Gesamtmoleküls hängt vom pH-Wert der Lösung ab. Im stark sauren Medium liegen Polykationen, im stark basischen Polyanionen vor. Durch die resultierende positive bzw. negative Überschussladung nehmen Hydratation und Löslichkeit zu. Dabei ist für die Hydratation allein die Absolutladung entscheidend. Der Ladungssinn ist für das elektrophoretische Verhalten, d.h. für die Wanderungsrichtung im elektrischen Feld, verantwortlich. Am isoelektrischen Punkt haben die P. keine Nettoüberschussladung. In der hier vorliegenden Zwitterionenform erreichen Löslichkeit und Hydratation ein Minimum. Die Ampholytnatur der P. ist von entscheidender Bedeutung für ihre Pufferwirkung in biologischen Systemen. Aufgrund der Hydratation sind die globulären P. in der Lage, hydrophobe Substanzen einzuschließen und vor Ausflockung zu schützen. Diese Schutzkolloidfunktion ist für die Stabilisierung von Körperflüssigkeiten wichtig. Durch den Zusatz schwach- oder nichtpolarer Lösungsmittel (z.B. Alkohol oder Aceton) kommt es ebenso wie durch hohe Neutralsalzkonzentrationen zur Entfernung der Hydrathülle und damit zur Ausflockung (Aussalzung) der P. Verschiedene P., z.B. die Serumglobuline, benötigen eine geringe Salzkonzentration zur Verhinderung ihrer Ausfällung. Dieser Einsalzeffekt beruht auf dem Zurückdrängen der geordneten (Assoziation) oder wahllosen (Aggregation) Zusammenlagerung von Proteinmolekülen durch die sich anlagernden Elektrolytionen. Ein wichtiges Reinheitskriterium ist das Löslichkeitsdiagramm, das für ein homogenes P. bis zum scharf umschriebenen Sättigungspunkt einen linearen Verlauf (Auftragung: zugegebene gegen gelöste Proteinmenge) aufweist.
Werden P. auf Temperaturen über 60 °C erhitzt, so entstehen tiefgreifende strukturelle Veränderungen, die gleichzeitig zum Verlust oder zur Beeinträchtigung der biologischen Aktivität der betreffenden P. führen. Diese Denaturierung beruht auf der Zerstörung der Tertiär- und Quartärstruktur der P. Sie kann außer durch Erhitzen auch durch UV- und Röntgenbestrahlung, durch extrem saure oder alkalische Behandlung, durch Einwirkung von Netzmitteln, z.B. von 1%iger Natriumdodecylsulfatlösung, oder durch Wasserstoffbrücken lösende Reagenzien wie 8M Harnstoff- und 6M Guanidinhydrochloridlösung erfolgen. Wird die Denaturierung in Gegenwart von Reduktionsmitteln vorgenommen, so werden außer den nichtkovalenten Bindungen auch die Disulfidbindungen gespalten. Ist die Denaturierung reversibel, so kann der native Zustand des P. wiederhergestellt werden (Renaturierung). Bei irreversibler Denaturierung, z.B. bei der Hitzedenaturierung des Ovalbumins (Kochen des Hühnereis), kommt es zur Ausbildung ungeordneter Gerüstkonformationen, die auch als statistische Knäuel (engl. random coil) bezeichnet werden.
Proteinfaltung, die Faltung eines Zufallsknäuelpolypeptids in seine native Struktur, d.h. seine dreidimensionale biologisch funktionelle Struktur oder native Konformation. Der Verlust dieser nativen Struktur ist als Denaturierung, die Wiederherstellung als Renaturierung bekannt.
In der lebenden Zelle faltet sich ein neu synthetisiertes Protein rasch und spontan in seine native dreidimensionale Struktur, Untereinheiten lagern sich zur Quartärstruktur zusammen (kooperative Selbst-Assemblierung). Im Gegensatz zur raschen und genauen Faltung von Proteinketten in lebenden Zellen verläuft die Renaturierung vieler entfalteter Proteine in vitro unter simulierten physiologischen Bedingungen jedoch relativ langsam und mit niedriger Effizienz. In der lebenden Zelle liegen Mechanismen vor, die die korrekte Faltung unterstützen und beschleunigen, beispielsweise unterstützen und beschleunigen faltungsakzessorische Proteine die korrekte Faltung und das korrekte Zusammenlagern zu Quartärstrukturen. Zusätzlich kann die Bildung von Disulfidbrückenbindungen in neu synthetisierten Proteinen die Struktur des posttranslationell modifizierten Proteins vorgeben (Insulin).
Die Proteinfaltung scheint in vivo in aufeinanderfolgenden Schritten abzulaufen. Zuerst werden kurze Abschnitte an α-Helices und β-Schleifen gebildet. Diese dienen als Kerne (Gerüst) zur Stabilisierung anderer geordneter Regionen des Proteins. An solchen Kernen sind 8-15 Reste beteiligt, wobei die Kerne nicht notwendigerweise ständig vorhanden sind, vielmehr werden sie innerhalb von Millisekunden gebildet und aufgelöst. Jene Kerne, die der nativen Konformation angehören, bleiben bestehen und wachsen kooperativ, möglicherweise durch Bildung einer Domäne, die gewöhnlich nicht mehr als 200 Reste enthält. Bei der Faltung von Multidomänenproteinen tritt eine Zwischenstufe mit ausgedehnter Sekundärstruktur, jedoch ungeordneter Tertiärstruktur auf, wodurch die hydrophoben Aminosäuren teilweise der wässrigen Lösung ausgesetzt sind. Dieses intermediäre Multidomänenprotein (engl. molten globule) durchläuft dann geringe Konformationsänderungen und erreicht die kompakte Tertiärstruktur des monomeren Proteins. Bei oligomeren Proteinen lagern sich die Monomere zu einer Vorstufe der Quartärstruktur zusammen. Kleine Konformationsänderungen führen zur nativen Quartärstruktur.
Wenn die native Konformation erreicht ist, werden durch die spezifische Bindung von Liganden (z.B. Enzymsubstrate, Liganden von Trägerproteinen, Liganden von Rezeptoren) weitergehende feine, aber entscheidende Änderungen induziert. Veränderungen dieser Art können berechnet und mit Hilfe von Computersimulationen aufgezeichnet werden.
Faltungsakzessorische Proteine sind z.B. die Protein-Disulfid-Isomerase, die Peptidyl-Prolyl-cis/trans-Isomerasen und die molekularen Chaperone.
Da die native Konformation eines Proteins ausschließlich durch seine Primärsequenz und seine intrazelluläre Umgebung bestimmt wird, ist es theoretisch möglich, diese native dreidimensionale Struktur aus der Aminosäuresequenz vorherzusagen. Eine empirische Methode berücksichtigt, dass Aminosäuren unterschiedliche Neigungen zeigen, in einer α-Helix oder einem β-Faltblatt vorzukommen. Die Neigung (propensity, P), in einer α-Helix vorzukommen, ist definiert als Pα = fα/<fα>, wobei fα die Häufigkeit ist, mit der ein Rest in einer α-Helix in einer Reihe von Proteinen vorkommt (fα = nα/n, nα entspricht der Häufigkeit, mit der die Aminosäure in α-Helices angetroffen wird, und n der Häufigkeit, mit der sie insgesamt in allen untersuchten Proteinen vorhanden ist) und
Nachweis und Bestimmung. P. können qualitativ durch Fällungsreaktionen mit Trichloressig-, Pikrin- oder Perchlorsäure, durch Schwermetall-Ionen (Cu-, Fe-, Zn- und Pb-Salze) oder durch spezifische Farbreaktionen nachgewiesen werden. Bei der Xanthoproteinreaktion z.B. entsteht eine Gelbfärbung beim Versetzen mit konz. Salpetersäure, bei der Biuretreaktion eine Purpurviolettfärbung durch Zusatz von Kupfersulfat zur stark alkalischen Proteinlösung und bei der Pauly-Reaktion eine Rotfärbung durch Behandlung der alkalischen Lösung mit Diazobenzensulfonsäure. Zur quantitativen P.-Bestimmung dient vor allem die Lowry-Methode. Hier wird ein mit dem P. gebildeter Kupferphosphomolybdänsäurekomplex (Absorptionsmaximum 750 nm) kolorimetrisch bestimmt und Human- oder Rinderserumalbumin als Eichsubstanz verwendet.
Beim klassischen Kjeldahl-Verfahren wird die Analysenprobe durch Kochen in konz. Schwefelsäure aufgeschlossen, wobei sich eine dem Stickstoffgehalt des P. äquivalente Menge Ammoniumsulfat bildet. Das daraus durch Alkalilauge freigesetzte Ammoniak wird acidimetrisch bestimmt. Eine direkte und schnelle Bestimmung von P. ist durch die Messung der UV-Absorption bei 280 nm möglich. Sie beruht auf der Anwesenheit von aromatischen Aminosäureresten (Tyr, Trp) in den meisten P. Der Absorptionskoeffizient E
![]()
dient bei gereinigten P. als Umrechnungsfaktor der erhaltenen Absorption einer Lösung unbekannten Proteingehalts in mg P./ml. E
![]()
beträgt z.B. für Trypsin 15,4.
Bestimmung von Mr. Hierzu stehen mehrere physikochemische Verfahren zur Verfügung, die sich in kinetische und in Gleichgewichtsmethoden unterteilen lassen. Zu den kinetischen Methoden, die auf der Auswertung von Erscheinungen des Partikeltransports beruhen, zählen unter anderem die Verfahren zur Bestimmung der Diffusions- und Sedimentationsgeschwindigkeit in der Ultrazentrifuge, der Viskosität, z.B. im Ubbelohde-Viskosimeter, sowie der elektrophoretischen bzw. gelchromatographischen Wanderungsgeschwindigkeit in Polyacrylamidgelen oder auf Dextrangelen bestimmter Porosität (Molekularsiebe). Gleichgewichtsmethoden, bei denen sich die zu untersuchende Proteinlösung im thermodynamischen Gleichgewicht befindet, sind unter anderem die Verfahren zur Bestimmung des osmotischen Drucks in einem Membranosmometer, der Lichtstreuung, bei der man den mit zunehmender Partikelgröße stark ansteigenden Tyndall-Effekt in einem Streulicht-Photometer misst, und der Röntgenkleinwinkelstreuung, die den Streumassenradius der P. mit Hilfe einer Spezialkamera ermittelt. Eine weitere speziell für P. mit Quartärstruktur oder für Multienzymkomplexe geeignete Methode zur Bestimmung der Molekülform und der Anzahl der Untereinheiten ist die Elektronenmikroskopie der mit Osmiumtetraoxid oder anderen Schwermetallen kontrastierten P. (Negativ-Anfärbe-Technik, Auflösungsvermögen bis 1,5nm). Sind die Aminosäurezusammensetzung und die Anzahl der tryptischen Peptide oder die Primärstruktur eines Proteins bekannt, kann die absolute Mr auch rechnerisch ermittelt werden.
Zu den häufigsten Verfahren zur Mr-Bestimmung von nativen und dissoziierten P. zählen die verschiedenen Ultrazentrifugenmethoden (Ultrazentrifugation, Dichtegradientenzentrifugation), die Gelfiltration, Gelchromatographie und die Polyacrylamid-Gelelektrophorese.
Bestimmung der Primärstruktur:Als erster Schritt ist es sinnvoll, die Aminosäurezusammensetzung zu ermitteln, d.h. eine Totalhydrolyse des Proteins mit nachfolgender quantitativer Bestimmung aller Aminosäuren im Hydrolysat durchzuführen. Für die Trennung und die quantitative Bestimmung von Aminosäuren in einem Gemisch stehen verschiedene Methoden zur Verfügung: Papierchromatographie, Hochspannungselektrophorese und Gas-Flüssigkeits-Chromatographie geeigneter Aminosäurederivate. Die säulenchromatographische Trennung aller Aminosäuren eines Proteins wird heute vollautomatisiert durchgeführt. Der Analysator sammelt automatisch den Kolonnenausfluss, fügt Ninhydrin hinzu, erwärmt zwecks Farbentwicklung, nimmt die Farbintensität auf und stellt die Intensität graphisch dar (Abb. 4; Aminosäurereagenzien).
Aus 1mg P. kann die Menge jeder Aminosäure (entspricht der Fläche unter den Peaks) mit einer Genauigkeit von einigen Prozent bestimmt werden. Die Analysendauer beträgt 20 Stunden. Die Analyse wird durch on-line-Berechnung der Ergebnisse und Ausgabe der Aminosäurezusammensetzung weiter erleichtert. Die gebräuchlichste Hydrolysemethode besteht in der Erhitzung des Proteins in 6M HCl bei 105-110 °C für 20-70 Stunden in einem verschlossenen Röhrchen. Ein Nachteil der Säurehydrolyse ist allerdings, dass einige Aminosäuren verändert werden (Tryptophan, Asparagin, Glutamin und Cystein). Eine alkalische Hydrolyse – 5M NaOH bzw. Ba(OH)2 bei 110 °C für 20 Stunden – wirkt besonders zerstörerisch und bewirkt Racemisierung, sie ist jedoch besonders zur Bestimmung von Tryptophan allein geeignet. Die meisten der genannten Probleme können bei einer Hydrolyse der P. mit 3M p-Toluolsulfonsäure mit 2% Thioglycolsäure in einem verschlossenen Röhrchen vermieden werden, wobei aber restliche p-Toluolsäure die Trennung der sauren Aminosäuren stören kann.
Einige P. können für analytische Zwecke auch mit Hilfe eines Gemischs von proteolytischen Enzymen hydrolysiert werden, wie z.B. Papain oder Subtilisin (beide ziemlich unspezifisch) in Verbindung mit Leucin-Aminopeptidase und Prolin-Iminopeptidase. Solche Hydrolysen sind jedoch oft unvollständig.
Die nächste Stufe bei der Bestimmung der Primärstruktur besteht in der reduktiven (2-Thioethanol) oder oxidativen (Perameisensäure) Spaltung der Disulfidbrücken mit nachfolgender enzymatischer (z.B. durch Trypsin) und/oder chemischer (z.B. durch Bromcyan) Spaltung der Peptidkette. Die Trennung der Spaltpeptide durch Ionenaustauschchromatographie in flüchtigen Puffern oder durch die Fingerprinttechnik, d.h. eine Kombination von Elektrophorese (1. Richtung) mit Chromatographie (2. Richtung) auf Dünnschichtplatten oder Papier. Schließlich werden die Aminosäurezusammensetzung sowie die N- und C-terminalen Endgruppen der Spaltpeptide bestimmt. Das wichtigste chemische Abbauverfahren ist der inzwischen vollautomatisierte Edman-Abbau.
Mittels vergleichender Untersuchungen der Primärstrukturen homologer Proteine aus verschiedenen Arten (z.B. Hämoglobin aus Vertebraten) oder analoger P. (z.B. Subtilisin aus Bacillus subtilis und Säugetiertrypsin) konnten Fragen der divergenten und konvergenten Evolution auf biochemischer Grundlage erfolgreich bearbeitet werden (molekulare Evolution). Für eine Erklärung der Proteinfunktionen und -eigenschaften, insbesondere der Wirkungsmechanismen der Enzyme, reicht die Primärstruktur allein nicht aus und es werden Kenntnisse der Sekundär- und Tertiärstruktur benötigt.
Bestimmung der Molekülgestalt. Die Molekülgestalt eines Proteins kann entweder aus Messungen der Viskosität, der Strömungsdoppelbrechung sowie der Sedimentations- und Diffusionsgeschwindigkeit oder direkt im Elektronenmikroskop ermittelt werden. Bei bekannter Mr erhält man den molaren Reibungskoeffizienten f meist aus Ultrazentrifugenmessungen, z.B. aus dem Sedimentationsverhalten: f = Mr(1 – vρ)/S. Hierbei ist v das partielle spezifische Volumen, ρ die Dichte und S die Sedimentationskonstante. Aus dem Reibungsquotienten f/f0, wobei f0 der f eines kugelförmigen Moleküls ist, lässt sich schließlich das Achsenverhältnis alb eines Proteins ableiten. Letzteres liegt bei den meisten globulären P. zwischen den Werten 2 und 20, bei den fibrillären P. über 20, z.B. für Fibrinogen = 30.
Isolierung und Reindarstellung. Während die Isolierung der in hohen Konzentrationen vorkommenden globulären P., z.B. von Hämoglobin aus Erythrocyten, von Casein aus Milch und von Ovalbumin aus dem Eiklar, sowie die Isolierung der unlöslichen fibrillären Strukturproteine keine besonderen Schwierigkeiten bereitet, erfordert die Gewinnung der nur in geringen Mengen auftretenden P. meist eine aufwendige Abtrennung von Begleitstoffen wie Kohlenhydraten, Lipiden, Nucleinsäuren und anderen Biomolekülen. Im ersten Schritt wird das biologische Material aufgeschlossen. Nach mechanischem Zerkleinern durch Homogenisatoren, Ultraschall, Schütteln mit Glasperlen, Zermörsern des in Aluminiumoxidkörnern eingefrorenen Gewebes, durch Detergensbehandlung u.a. erhält man ein Zellhomogenisat, aus dem die P. mit Salzlösungen, Glycerin, verd. Säuren oder anderen Extraktionsmitteln herausgelöst werden. Im zweiten Schritt erfolgt eine Vortrennung der P. durch fraktionierte Ammoniumsulfatfällung oder durch Lösungsmittelfraktionierung nach Cohn, anschließend eine weitere Reinigung durch Gelfiltration, Ionenaustausch- oder Adsorptionschromatographie, gegebenenfalls auch durch präparative Elektrophorese, durch isoelektrische Fokussierung, durch Affinitätschromatographie oder durch Ionenfiltrationschromatographie, d.h. eine Kombination von Ionenaustausch- und Gelchromatographie.
Als Reinheitskriterium für P. dient ihre Homogenität (Einheitlichkeit). Ein "reines" Proteinpräparat (das nur ein P. enthält) kann anorganische Salze, andere kleine organische Moleküle (z.B. Substrate, Coenzyme) und Wasser enthalten. Sogar ein kristallisiertes P. enthält viel Wasser und möglicherweise weitere kleine Moleküle und Ionen. Insbesondere bei der Untersuchung der Quartärstruktur stellt sich die Frage nach der Proteinhomogenität, da bestimmt werden muss, ob die Untereinheiten identisch sind oder nicht. Die Homogenität kann bestimmt werden durch analytische Diskelektrophorese (eine Proteinbande) und analytische Ultrazentrifugation (eine einzige symmetrische Bande), Löslichkeitsdiagramm und pI. Bei den Enzymen kommen die Aktivitätskriterien (pH- und Temperatur-Optimum, Substratspezifität, kinetisches Verhalten) als weitere Faktoren für die Homogenität hinzu.
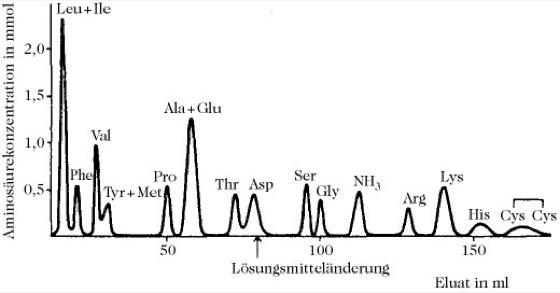
Proteine. Abb. 4. Säulenchromatographische Auftrennung eines Säurehydrolysats des Serumalbumins im automatischen Aminosäureanalysator (nach Moore und Stein).
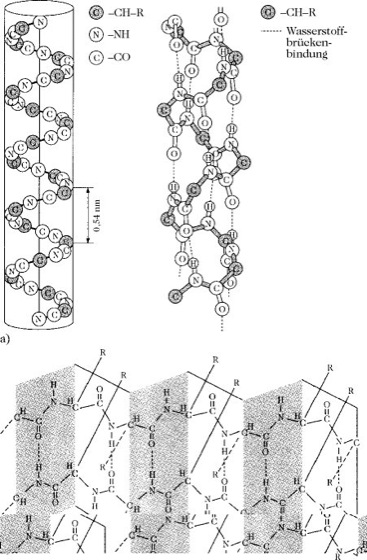
Proteine. Abb. 1. Sekundärstruktur von Proteinen: a) α-Helix, b) antiparallele Faltblattstruktur.
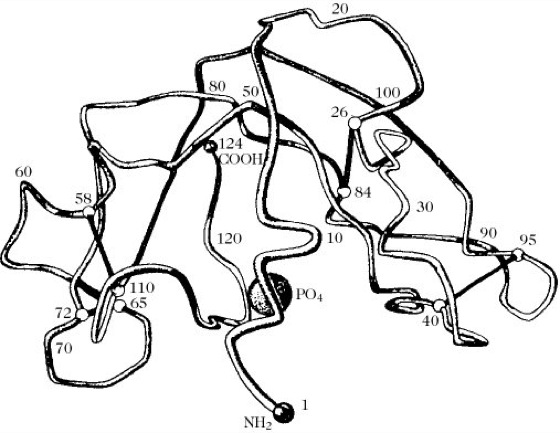
Proteine. Abb. 2. Tertiärstruktur der Ribonuclease A nach Kartha.
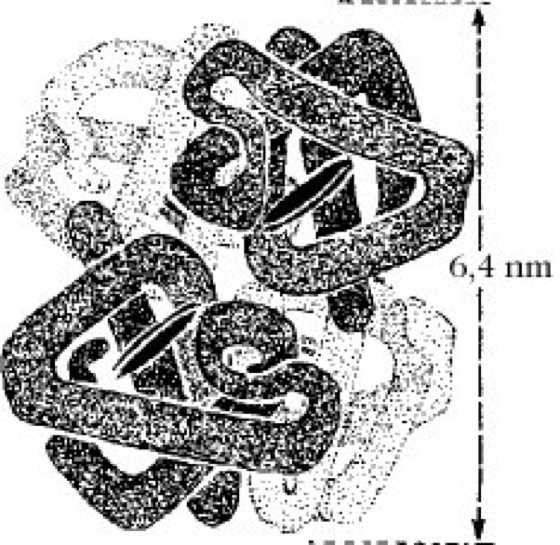
Proteine. Abb. 3. Quartärstruktur des Hämoglobins. Schema der räumlichen Anordnung der α- und β-Ketten. Die schwarze Scheibe stellt die Hämgruppe dar.
Schreiben Sie uns!