Lexikon der Biochemie: Steroide
Steroide, Verbindungen, die sich von dem tetrazyklischen Kohlenwasserstoff Perhydro-1H-cyclo-penta[a]-phenanthren (Trivialname bei unbekannter Stereochemie Steran, bei trans-Stellung der Ringe B/C und C/D Gonan) ableiten. Wichtige Gruppen natürlich vorkommender S. sind die Sterine, Gallensäuren, Steroidhormone und Cardenolide (herzwirksame Glycoside) sowie verschiedene N-haltige S. (Steroidalkaloide). Zu den S. gehören ferner zahlreiche Sapogenine (Saponine). Von den zahlreichen synthetischen S. haben z.B. die Ovulationshemmer, die Anabolika und zahlreiche weitere strukturmodifizierte Steroidhormone große pharmakologische Bedeutung.
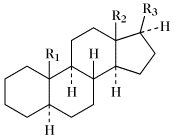
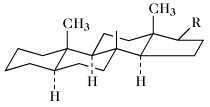
Struktur, Nomenklatur. Die Kennzeichnung des tetrazyklischen Ringgerüsts (oft als "Steroidkern" bezeichnet) und die Bezifferung des Kohlenstoffskeletts zeigt Abb. 1. Die IUPAC-IUB Joint Commission on Biochemical Nomenclature empfahl 1989 ein neues Kohlenstoffnummerierungssystem [Eur. J. Biochem. 186 (1989) 429-458], das das früher empfohlene ersetzte [Eur. J. Biochem. 10 (1969) 1-19; Eur. J. Biochem. 25 (1972) 1-3]. Dadurch änderte sich die Nummerierung der Kohlenstoffatome von 28, 29, 30, 31 und 32 (in Abb. 1 fettgedruckt) zu 241, 242, 28, 29 und 30 (in Abb. 1 innerhalb der Ellipsen gezeigt).
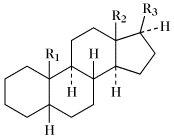
Die Ringe A/B, B/C und C/D können cis oder trans miteinander verbunden sein. Bei den natürlich vorkommenden S. sind die Ringe B/C immer trans verknüpft. Die meisten S. leiten sich vom Gonan ab. Bei den Cardenoliden und Bufadienoliden sind die Ringe C/D cis verknüpft. Zahlreiche S. enthalten jedoch Doppelbindungen in den Ringen A oder B und sind daher mehr oder weniger stark eingeebnet. Als Bezugspunkt für stereochemische Angaben dient die CH3-Gruppe in 13-Stellung, die immer oberhalb der Ringebene, also β-ständig, angeordnet ist. Nach der Orientierung des H-Atoms in 5-Stellung (α- oder β-ständig) wird zwischen der 5α- und 5β-Reihe unterschieden (Tab.). Bei der 5α-Reihe sind die Ringe A/B trans, bei der 5β-Reihe cis verknüpft. Die meisten natürlich vorkommenden S. haben CH3-Gruppen in 13- (z.B. Östran) bzw. 10- und 13-Stellung (z.B. Androstan), sowie eine Sauerstofffunktion (Hydroxy-, Oxogruppe) in 3-Stellung. Sie enthalten meist einen Alkylrest in 17-Stellung.
Bei einer Doppelbindung, die nicht zwei in der Ziffernfolge aufeinanderfolgende C-Atome verbindet, wird das höhere C-Atom in Klammern hinter dem niedrigeren C-Atom angegeben, z.B. bedeutet 8(14)-en, dass die Doppelbindung zwischen C8 und C14 vorliegt. Die Lage der Doppelbindung kann auch als Hochzahl des griechischen Buchstabens Δ angegeben werden, z.B. kennzeichnet Δ5,8(14)-Cholestandien-3β-ol ein S. mit einer Doppelbindung zwischen C5 und C6 sowie einer weiteren zwischen C8 und C14. Diese Kennzeichnung sollte laut der IUPAC-IUB-Empfehlung von 1989 nicht mehr verwendet werden, ist aber in der wissenschaftlichen Literatur immer noch weit verbreitet.
Der in vielen natürlichen S. vorkommende 17β-Substituent enthält 2-10 Kohlenstoffatome und wird als "Seitenkette" bezeichnet. Je nach Länge besitzt er ein oder zwei asymmetrische Zentren, und zwar C20 und C24. Um die Konfiguration an diesen Zentren zu bestimmen, werden das α/β-System [L.F. Fieser u. M. Fieser Steroids 4. Auflage (1959) 337-340] und die R/S-(Cahn-Ingold-Prelog-)Konvention verwendet [R.S. Cahn J. Chem. Educ. 41 (1964) 116-125]. Für die Bezeichnung spezifischer Verbindungen wird aufgrund der IUPAC-IUB-Empfehlung vom α/β-System abgeraten, es wird jedoch für Enzymnamen beibehalten, z.B. 20α-Hydroxysteroid-Dehydrogenase. Gegenüber dem R/S-System hat das α/β-System den Vorteil, dass es unabhängig von den Substituenten benachbarter Atome ist. Es ist in der wissenschaftlichen Literatur weit verbreitet.
Ringkontraktionen werden unter Angabe des Ringes (A, B, C, D) durch das Präfix nor-, Ringerweiterungen durch homo- gekennzeichnet, z.B. A-nor-, D-homo-, Ringöffnungen werden durch das Präfix seco- unter Angabe der C-Atome bezeichnet, zwischen denen die Öffnung erfolgt ist, z.B. 9,10-seco- bei den Calciferolen.
Biosynthese. Sie erfolgt aus Acetyl-CoA. Die ersten Biosyntheseschritte, die zum nichtzyklischen Triterpen Squalen führen, werden beim Stichwort Terpene diskutiert. Squalen wird zu all-trans-(3S)-2,3-Epoxysqualen oxidiert, das bei nichtphotosynthetischen Organismen zu Lanosterin und bei photosynthetischen Organismen zu Cycloartenol zyklisiert (Abb. 2). Lanosterin ist die biosynthetische Vorstufe der Zoosterine (z.B. Cholesterin) und Mycosterine (z.B. Ergosterin; Abb. 3), während Cycloartenol die Vorstufe der Phytosterine (z.B. Sitosterin; Abb. 4) ist. Weitere biologische Umwandlungen von Cholesterin in eine Vielzahl von wichtigen tierischen S. werden durch Seitenkettenspaltung zu Pregnenolon (Abb. 5) eingeleitet. Fleischfressende Insekten nutzen Cholesterin aus der Nahrung als Vorstufe für Ecdysone. Pflanzenfressende Insekten synthetisieren Ecdysone aus Phytosterinen der Nahrung, wobei eine Dealkylierung an C24 durchgeführt wird.
Lanosterin und Cycloartenol werden wegen der drei zusätzlichen Methylgruppen (in 4,4- und 14-Stellung) als Methylsterine bezeichnet und zu den Triterpenen gezählt.
Vorkommen. S. kommen in Tieren, Pflanzen und Mikroorganismen, insbesondere Pilzen, vor. In Pilzen sind die Sterine und Steroidcarbonsäuren der Ergostan- und Stigmastanreihe sowie Methylsterine enthalten. Verbreitetstes Sterin ist das Ergosterin. Die S. der Tiere werden aus Cholesterin gebildet. Aus dem Cholesterin entstehen in den Säugetieren bei weitestgehendem Abbau der Seitenkette am C17-Atom die Steroidhormone (Pregnan-, Androstan- und Östranreihe). Bei den Wirbellosen wirken die Ecdysteroide als Häutungshormone. Abbauprodukte des Cholesterins sind die Gallensäuren, bei denen es sich um Steroidcarbonsäuren handelt. Die Struktur der pflanzlichen S. ist durch Vergrößerung der Alkylkette am C17-Atom (Stigmastanreihe), durch Bildung zusätzlicher O- und N-haltiger Ringe (Saponine, Steroidalkaloide) oder durch das Vorhandensein eines ungesättigten Lactonringes (Cardenolide, Bufadienolide) wesentlich vielfältiger. Pflanzliche S. liegen meist als Glycoside vor, wobei der Zuckerrest vorwiegend an der 3β-Hydroxygruppe gebunden ist. In Erdöl wurden Steroidcarbonsäuren gefunden.
Steroide. Tab. Wichtige Stammkohlenwasserstoffe der Steroide. Soweit nicht anders angegeben, sind die Namen für die entsprechenden 5α- und 5β-Verbindungen gleich.
| |||
 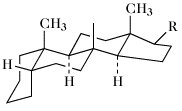 5β-Reihe | |||
| Name | R1 | R2 | R3 |
| 5α-Gonan (früher Steran); 5β-Gonan | H | H | H |
| Östran | H | CH3 | H |
| 5α-Androstan (früher Testan); 5β-Androstan (früher Ätiocholan) | CH3 | CH3 | H |
| 5α-Pregnan (früher Allopregnan); 5β-Pregnan | CH3 | CH3 | (20R)-C2H5 |
| 5α-Cholan (früher Allocholan); 5β-Cholan | CH3 | CH3 | (20R)-CH(CH3)CH2CH2CH3 |
| 5α-Cholestan; 5β-Cholestan (früher Koprostan) | CH3 | CH3 | (20R)-CH(CH3)CH2CH2CH2CH(CH3)2 |
| Ergostan | CH3 | CH3 | (20R,24S)-CH(CH3)CH2CH2CH(CH3)CH(CH3)2 |
| Campestan | CH3 | CH3 | (20R,24R)-CH(CH3)CH2CH2CH(CH3)CH(CH3)2 |
| Poriferastan | CH3 | CH3 | (20R,24S)-CH(CH3)CH2CH2CH(C2H5)CH(CH3)2 |
| Stigmastan | CH3 | CH3 | (20R,24R)-CH(CH3)CH2CH2CH(C2H5)CH(CH3)2 |
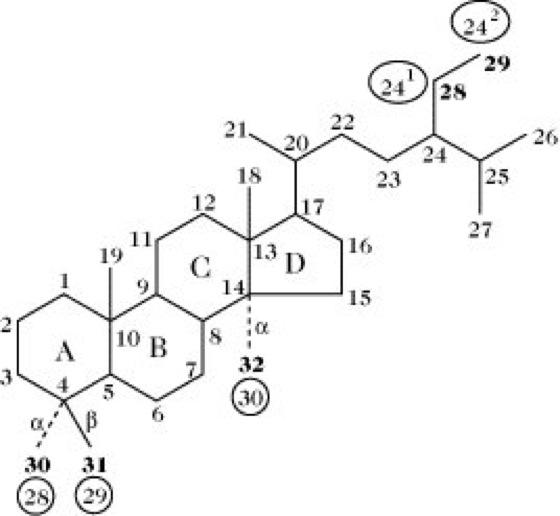
Steroide. Abb. 1. Ringnomenklatur und Nummerierung der Kohlenstoffatome im Steroidmolekül. In den Ellipsen angezeigte Nummern entsprechen der IUPAC-Empfehlung von 1989, fettgedruckte der zuvor gültigen von 1969. Alle anderen Nummerierungen blieben unverändert.
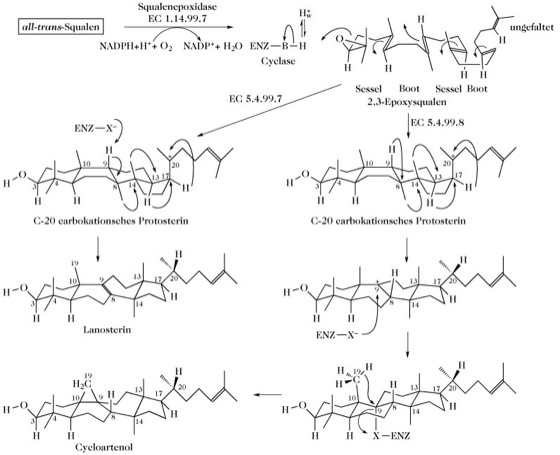
Steroide. Abb. 2. Biosynthese des Steroidringsystems aus Squalen. Die Squalen-Epoxidase, eine FAD-abhängige Flavoprotein-Monooxygenase, katalysiert die Oxidation von all-trans-Squalen zu all-trans-(3S)-2,3-Epoxysqualen. Dieses zyklisiert, katalysiert durch zwei unterschiedliche Cyclasen, zu Lanosterin oder Cycloartenol. Beide Cyclasen katalysieren zuerst eine Vorwärtszyklisierung, wobei durch den Angriff eines Protons auf die Epoxy-O-C2-Bindung eine Welle von Elektronenverschiebungen hervorgerufen und das gleiche Protosterin-C20-Carbokation als Zwischenstufe gebildet wird. Die Rückumlagerung dieses Carbokations katalysieren die Cyclasen, indem sie eine Reihe von Wagner-Meerwein-Verschiebungen unterstützen (d.h. aufeinanderfolgende trans-1,2-Verschiebungen von H- bzw. H3C-). Im Fall der Lanosterin-bildenden Cyclase finden vier solcher Verschiebungen statt: 1) 17α-H (nicht 17β, wie früher angenommen) nach C20, welches die R-Konfiguration erhält, 2) 13α-H nach C17, wo es in 17α-H übergeht, 3) 14β-CH3 nach C13, wo es 13β-CH3 bildet, 4) 8α-CH3 nach C14, wo es in 14α-CH3 übergeht; das Enzym stabilisiert dann das gebildete C8-Carbokation, indem es 9β-H als Proton abspaltet und eine 8,9-Doppelbindung einführt. Die Cycloartenol-bildende Cyclase katalysiert die gleichen beschriebenen vier Verschiebungen und führt noch eine fünfte zusätzlich aus: 5) 9β-H nach C8, wo es in 8β-H übergeht. Das Enzym stabilisiert dann das gebildete C9-Carbokation, indem es eines der C9-Wasserstoffatome als Proton abspaltet und die neu zur Verfügung stehenden Elektronen dazu nutzt, eine C9-C19-Bindung zu knüpfen, wobei ein 9β,19-Cyclopropanring entsteht. Dieser Schritt kann aus sterischen Gründen nicht in einer konzertierten 9β-H-Verschiebung bestehen. Aus diesem Grund wird er vermutlich in zwei Einzelschritten durchgeführt. Wahrscheinlich wird das C9-Carbokation durch eine nucleophile Gruppe (X-) des katalytischen Zentrums der Cyclase stabilisiert und anschließend die trans-Eliminierung des C19-Wasserstoffs und des Enz-X- durchgeführt, begleitet von einer C-C-Bindungsbildung.
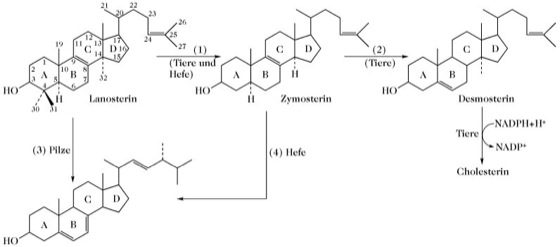
Steroide. Abb. 3. Biosynthese von Cholesterin (Tiere) und Ergosterin (Pilze) aus Lanosterin. Alle aufgeführten Reaktionen werden durch Enzyme des endoplasmatischen Reticulums durchgeführt. (1) Bei Tieren und der Hefe wird Zymosterin aus Lanosterin durch sequenzielle Oxidation und Abspaltung von C-32, C-31 und C-30 gebildet. (2) Doppelbindungsumwandlung im Ringsystem führt bei Tieren weiter zu Desmosterin. (3) Bei Hefen wird Zymosterin an C-24 methyliert, anschließend folgt eine Doppelbindungsumwandlung im Ringsystem und Sättigung der C-24,28-Seitenkettendoppelbindung. Abschließende Bildung der C-22,23-Seitenkettendoppelbindung ergibt Ergosterin. (4) Pilze bilden Ergosterin durch Methylierung des C-24 von Lanosterin mit nachfolgender sequenzieller Oxidation und Abspaltung von C-32, C-31 und C30. Die weiteren Schritte sind identisch mit den bei (3) für Hefe beschriebenen.
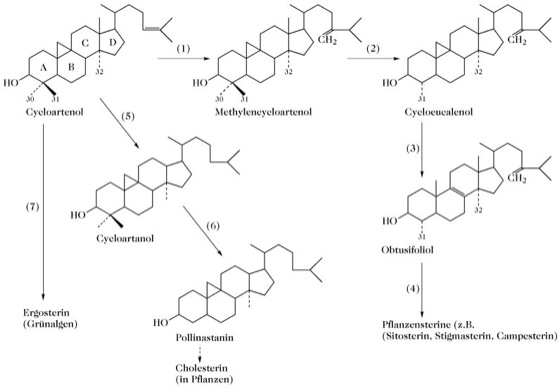
Steroide. Abb. 4. Einige biologische Umwandlungen des Cycloartenols. Bei grünen Pflanzen stammen alle Sterine von Cycloartenol ab. Cholesterin, das vorherrschende tierische Steroid, ist in Pflanzen als Nebensterin weit verbreitet; in einigen Pflanzengeweben, wie z.B. den Compositen-Pollen ist es nicht vorhanden. Bei Pflanzen ist Cholesterin die biologische Vorstufe von Phytoecdysonen, Cardenoliden und Steroidhormonen, die wahrscheinlich bei Abwehrmechanismen gegen pflanzenfressende Tiere eine Rolle spielen. (1) Methylierung an C-24; (2) oxidative Abspaltung von C-30, C-31-Methylgruppe invertiert zur 24α-Konfiguration; (3) Öffnung des 9β-19-Cyclopropanrings; (4) oxidative Abspaltung von C-32 und C-31, Doppelbindungsumwandlung im Ringsystem, Sättigung der C-24,28-Doppelbindung (manchmal Bildung der C-22,23-Doppelbindung), zusätzliche Methylierungen durch S-Adenosylmethionin. (5) Sättigung der C-24,25-Doppelbindung; (6) oxidative Abspaltung von C-30 und C-31. (7) a) Bildung von Cycloartenol, b) C-30-Demethylierung, c) Öffnung des Cyclopropanrings, d) C-31- und C-32-Demethylierung, d) Doppelbindungsumwandlung im Ringsystem, e) Sättigung der C-25,26-Doppelbindung und Bildung der C-22,23-Doppelbindung.
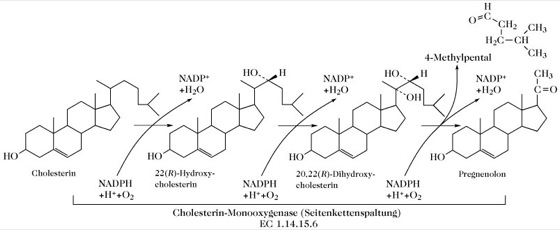
Steroide. Abb. 5. Umwandlung von Cholesterin in Pregnenolon durch oxidative Seitenkettenspaltung. Dies ist ein essenzieller erster Schritt in der Biosynthese von Progesteron, Androgenen, Östrogenen und Nebennierenrindensteroiden aus Cholesterin.
Schreiben Sie uns!