Lexikon der Biochemie: transfer-RNA
transfer-RNA, tRNA, veraltete Bezeichnungen: sRNA (von engl. soluble RNA), lösliche RNA, Akzeptor-RNA, Transport-RNA; ubiquitär verbreitete RNA-Form mit essenzieller Bedeutung für die Proteinbiosynthese. tRNA dient der Übersetzung der Nucleotidsequenz der messenger-RNA in die Aminosäuresequenz der Proteine. Die Zahl der Nucleotide in den verschiedenen tRNA-Arten liegt zwischen 70 und 85, das mittlere Mr bei 25kDa. Für jede der 20 proteinbildenden Aminosäuren gibt es mindestens eine spezifische tRNA je Zelle. Da jedoch Organellen- und Artspezifität zur weiteren Multiplizität der tRNA beitragen, dürfte die wirkliche Zahl der tRNA-Spezies in einer Zelle bei 50 bis 70 liegen. Zur genaueren Unterscheidung sind Kurzbezeichnungen üblich, z.B. bedeutet tRNAValHefe die für Valin spezifische tRNA-Spezies aus Hefe.
Funktion. Die tRNA wird durch eine spezifische Aminoacyl-tRNA-Synthetase mit einer Aminosäure verestert und als Aminoacyl-tRNA an den Akzeptorort der 50S-Untereinheit eines Ribosoms gebunden. Gleichzeitig findet die antiparallele Basenpaarung zwischen dem Anticodon der tRNA und dem komplementären Codon einer mRNA am Polyribosom statt. Diese Basenpaarungsspezifität sichert den Einbau der Aminosäure an der richtigen Position in der wachsenden Polypeptidkette. Während des Translationsvorgangs wird die tRNA desacyliert, freigesetzt und steht einer erneuten Beladung mit der geeigneten Aminosäure zur Verfügung.
Struktur. Die Primärstrukturen von mehr als 50 unterschiedlichen tRNA-Arten aus verschiedenen Organismen sind bekannt. Als erste tRNA-Struktur und Nucleinsäuresequenz überhaupt hatte 1965 Holley die Primärstruktur der tRNAAlaHefe aufgeklärt. Das Vorkommen einer Reihe von seltenen Nucleinsäurebausteinen erleichtert die Identifizierung der durch Nucleasen in Oligonucleotidfragmente aufgespaltenen Nucleotidsequenz der tRNA. Bei maximaler Basenpaarung der Primärstrukturen ergibt sich eine charakteristische Sekundärstruktur (Kleeblattmodell).
Bei allen tRNA-Molekülen bildet das 3'-Ende die Sequenz 3'-ACC. Das 3'-terminale Adenin ist vom ersten Nucleosid der TΦC-Schleife (Ribothymidin oder Uridin) immer 21 Nucleoside entfernt. Das 5'-Ende ist immer phosphoryliert. Ein Aminoacyl-tRNA-Molekül, das an das Ribosom bindet und aktiv an der Proteinbiosynthese teilnimmt, trägt die Aminosäure als Ester in Position 3' des 3'-terminalen Adenosinrests. Dagegen stellt die freie Aminoacyl-tRNA ein tautomeres Gemisch an 2'- und 3'-Aminoacyl-tRNA dar. Als anfängliches Produkt der Aminoacyl-tRNA-Biosynthese tritt entweder das 2'- oder das 3'-Aminoacylderivat auf, je nach Spezifität der Aminoacyl-tRNA-Synthetase. Das hochspezifische Erkennen einer tRNA durch die entsprechende Aminoacyl-tRNA-Synthetase (Aminosäure-aktivierendes Enzym) liegt offenbar in der Raumstruktur jeder tRNA begründet. Röntgenstrukturanalysen an den tRNA-Kristallen zeigten, dass die typische Kleeblattstruktur mit vier Bereichen intramolekularer Basenpaarungen zwischen drei Schleifenabschnitten eine einheitliche Raumstruktur einnimmt (Abb., Farbtafel). Die TΦC- und di-HU-Schleifen und -Stiele sind zurückgefaltet, so dass das Molekül eine kompakte Form von 9nm Länge und 22,5nm Breite erhält. Die Anticodon-Schleife und das 3'-Ende sind weit voneinander getrennt, übereinstimmend mit dem Kleeblattmodell. Zusätzlich zu den Wasserstoffbrückenbindungen zwischen den Basen der helicalen Stiele wird die Struktur durch ein ausgedehntes Netzwerk an Wasserstoffbrückenbindungen, spezifischen Wechselwirkungen zwischen den Rückgrat-bildenden Basen und Ribosemolekülen sowie einiger Wasserstoffbrückenbindungen zwischen Basenpaaren außerhalb der Helices stabilisiert.
Synthese und Prozessierung. Die tRNA wird an der DNA als Vorläufer-tRNA-Molekül synthetisiert, das z.B. bei der tRNATyrE. coli aus 126 Nucleotiden besteht und 41 Nucleotide länger ist als das reife, aktive Molekül. Während der Prozessierung wird diese zuerst gebildete Sequenz durch eine spezifische Endonuclease gespalten. Im Zuge weiterer posttranskriptioneller Veränderungen werden Nucleotide durch methylierende oder andere Enzyme verändert. Die daraus resultierenden seltenen Nucleinsäurebausteine sind eine Ursache für die Ausbildung der für jede tRNA spezifischen Raumstruktur.
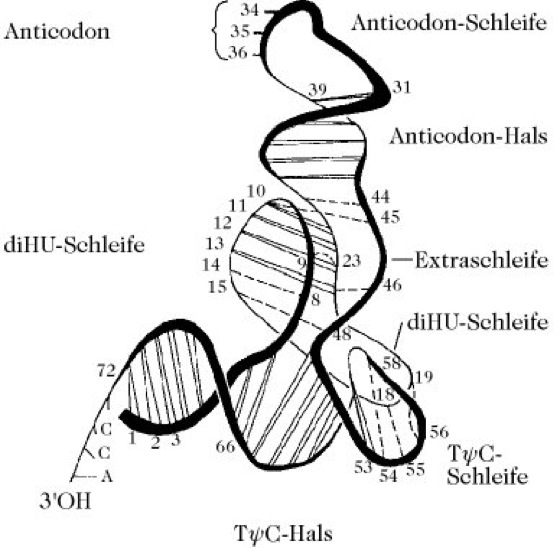
transfer-RNA. Dreidimensionale Struktur der Hefe-tRNAPhe, bestimmt durch Röntgenstrukturanalyse. Doppelte Linien stellen Wasserstoffbrückenbindungen zwischen den Basen der helicalen Stiele dar. Gestrichelte Linien zeigen Wasserstoffbrückenbindungen zwischen Basen außerhalb der Helices.
Schreiben Sie uns!