Lexikon der Chemie: Bor
Bor, Symbol B, chem. Element aus der III. Hauptgruppe des Periodensystems, der Bor-Aluminium-Gruppe, Halbmetall; Z 5, Massenzahlen der natürlichen Isotope 10 (19,78 %) und 11 (80,22 %), Atommasse 10,811, Wertigkeit III, Standardelektrodenpotential -0,73 V (B + 3 H2O
![]()
H3BO3 + 3 H+ + 3e).
Eigenschaften. B. existiert in einer tetragonalen und zwei rhombischen Modifikationen. Diese kristallinen Formen enthalten B12-Ikosaeder und unterscheiden sich lediglich in der Art der Verknüpfung dieser Grundbausteine untereinander. Der Zusammenhalt der zwölf Boratome innerhalb der Ikosaeder wie auch die Bindung zwischen den B12-Polyedern wird am besten durch Mehrzentrenbildungen beschrieben. Das kristalline B. bildet grauschwarze Kristalle, D. 2,34 bis 2,37 g cm-3, F. etwa 2300 °C, Kp. 2550 °C, ist sehr hart (Härte nach Mohs 9,3) und extrem reaktionsträge. Daneben kennt man eine amorphe Modifikation. Letztere ist sehr reaktionsfähig, entzündet sich an der Luft bei 700 °C und verbrennt mit rötlicher Flamme zu Bortrioxid B2O3. Mit Schwefel bildet amorphes B. Bortrisulfid B2S3. Mit Fluor erfolgt schon bei Zimmertemperatur heftige Reaktion zu Bortrifluorid BF3, die übrigen Borhalogenide bilden sich bei erhöhter Temperatur ebenfalls aus den Elementen. Die Einwirkung von Stickstoff oder Ammoniak bei etwa 900 °C führt zu Bornitrid BN. Alkalische Schmelzen überführen B. in Gegenwart von Luft in Metallborate. B. vermag bei hoher Temperatur zahlreiche Elementoxide, -sulfide oder auch -halogenide zu den entsprechenden Elementen zu reduzieren, z. B. 3 SiO2 + 4 B → 3 Si + 2 B2O3.
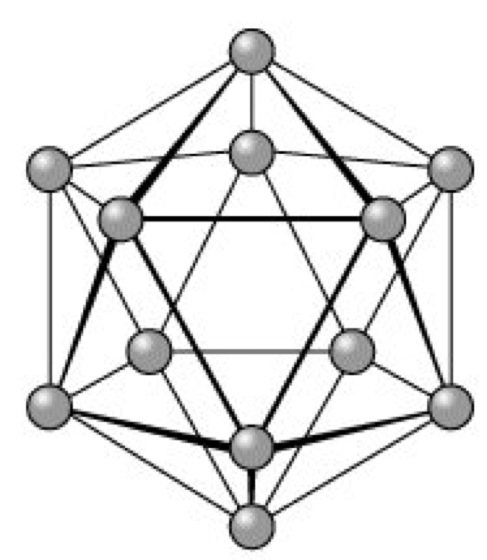
Bor. Abb.: B12-Ikosaeder.
Analytisches. Der qualitative Nachweis des B. beruht auf der durch Verbrennung flüchtiger Borverbindungen verursachten grünen Flammenfärbung.
Vorkommen. B. ist am Aufbau der Erdkruste zu etwa 5·10-3% beteiligt. Es kommt in der Natur als Borsäure, z. B. als Sassolin oder gelöst in Mineralquellen, und in Form ihrer Salze, der Borate, vor. Wichtige Minerale sind Borax (Tinkal) Na2B4O6 ·10 H2O, Kernit Na2B4O7 ·4 H2O, Borocalcit CaB4O7 ·4 H2O, Boracit 2 Mg3B8O15 ·MgCl2 Colemanit Ca2B6O11 ·5 H2O und Pandermit Ca2B6O11 ·3 H2O. Im Boden und in der pflanzlichen Natur kommt B. als Spurenelement vor. Es ist an der Zellteilung und an der Regelung des Calciumhaushaltes der Pflanzen beteiligt. Bormangel verursacht z. B. die Herz- und Trockenfäule der Zuckerrübe. Borarmen Böden wird das Element deshalb in Form von Mischdüngern zugeführt.
Gewinnung. Die Herstellung des kristallinen B. erfolgt durch Elektrolyse eines geschmolzenen Gemisches von Bortrioxid B2O3, Kaliumtetrafluoroborat KBF4 und Kaliumchlorid KCl oder auch durch Reduktion von Bortrichlorid BCl3 mit Wasserstoff im elektrischen Lichtbogen.
Verwendung. B. dient in der Metallurgie als Desoxidationsmittel und Legierungsbestandteil. Beispielsweise wird die Härtbarkeit des Eisens bereits bei geringen Borzusätzen bedeutend erhöht. Wegen des großen Einfangquerschnittes für Neutronen wird das Isotop 10B als Neutronenabsorber in der Kerntechnik verwendet. Kristallines B. kommt, gegebenenfalls nach Dotierung, in der Halbleitertechnik zur Anwendung. Durch Reduktion von Bortrioxid mit Aluminium erhältliches "quadratisches B." AlB12 wird wegen seiner großen Härte als Schleifmittel (Bordiamant) genutzt.
Schreiben Sie uns!