Lexikon der Chemie: Siliciumdioxid
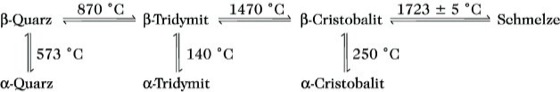
Alle diese kristallinen Formen enthalten SiO4-Tetraeder. Neben diesen Erscheinungsformen kennt man noch zwei Hochdruckmodifikationen des S.: Coesit und Stishovit, in denen jedes Si-Atom oktaedrisch von sechs Sauerstoffatomen umgeben ist.
S. ist chemisch sehr widerstandsfähig. Durch Fluorwasserstoffsäure wird es zu Siliciumtetrafluorid SiF4 und Wasser abgebaut. Von anderen Säuren wie auch von Chlor, Brom und Wasserstoff wird es nicht angegriffen. Alkalischmelzen wandeln S. in Silicate um, z. B. SiO2 + 2 NaOH → Na2SiO3 + H2O.
In der Natur ist S. außerordentlich verbreitet. Die wichtigste Erscheinungsform ist der Quarz, der in z. T. verunreinigten Abarten auch als Edel- und Halbedelstein vorkommt, z. B. als wasserklarer Bergkristall, brauner Rauchquarz, violetter Amethyst, rosafarbener Rosenquarz, gelber Citrin und schwarzer Morion. Besonders in Form seines Verwitterungsproduktes, des Sandes, findet Quarz ausgedehnte Verwendung in der Baustoff- und Glasindustrie sowie zur Herstellung von Silicium und bestimmten Silicaten, unter anderem des Wasserglases.
Kühlt man geschmolzenes S. ab, so erhält man eine unterkühlte Schmelze von amorphem glasartigem S. (Quarzglas), das besonders wegen seines kleinen Ausdehnungskoeffizienten, seiner Durchlässigkeit für ultraviolette Strahlung und seiner chem. Resistenz einen wertvollen Werkstoff für hochtemperaturbeständige Laboratoriumsgeräte und UV-Strahlungsquellen darstellt. Amorphe Formen des S. kommen auch in der Natur vor, z. B. die z. T. als Schmucksteine verwendeten Minerale Achat, Opal, Carneol, Onyx, Jaspis, Chrysopras sowie die erdige Kieselgur.
Schreiben Sie uns!