Lexikon der Neurowissenschaft: Alzheimer-Krankheit
Alzheimer-Krankheit w, Alzheimersche Krankheit, Morbus Alzheimer, Alzheimer-Demenz, senile Demenz vom Alzheimer-Typ, präsenile Sklerose, E Alzheimer´s disease, eine fortschreitende Erkrankung des Gehirns mit irreversiblen morphologischen und biochemischen Veränderungen von Gehirnarealen, besonders im Bereich des Hippocampus und des Assoziationscortex. Die Krankheit wurde erstmals von dem deutschen Neurologen Alois Alzheimer beschrieben. Schätzungen zufolge leiden 0,3% der 60-69-Jährigen, 3,2% der 70-79-Jährigen und 10,8% der 80-89-Jährigen an dieser Krankheit. Von den beobachteten Demenzen alter Menschen (Altersdemenz) sind ca. 50% Demenzen vom Alzheimer-Typ. Die Leitsymptome sind vor allem ein Gedächtnisschwund, vermindertes Lernvermögen, zeitliche und örtliche Desorientierung sowie Sprachstörungen. Die Krankheit verschlimmert sich fortschreitend und führt letztendlich nach vollständigem Verlust von Gedächtnis, Körperkontrolle und Sprache zum Tod. Klinisch ist es manchmal schwierig, die Alzheimer-Krankheit von anderen Demenzen (wie z.B. der Multi-Infarkt-Demenz) zu unterscheiden. Zwischen dem Auftreten der ersten Zeichen der Erkrankung und dem Tod liegen meist 8 bis 15 Jahre. Risikofaktoren sind familiäres Vorkommen, Schlaganfälle (Schlaganfall), vorausgegangene Schädel-Hirn-Traumata, aber auch erhöhter Cholesterinspiegel und erniedrigter Östrogen-Spiegel bei Frauen in der Menopause. Eine frühe und sichere Diagnostik wird durch die unspezifische Symptomatik erschwert, so daß sie meist nur durch das Ausschlußverfahren zustande kommt. Computertomographie, Elektroencephalogramm (EEG), Untersuchungen der Cerebrospinalflüssigkeit, sowie Wahrnehmungs- und Lerntests sollen zur Diagnose führen. Wenn eine therapierbare Ursache der Symptome ausgeschlossen werden muß, ist es unter Umständen vertretbar, eine Hirnbiopsie durchzuführen. Neuerdings verspricht man sich von neuroradiologischen Untersuchungen und Positronenemissionstomographie (PET) eine bessere Diagnose. Der reduzierte Glucosestoffwechsel in den betroffenen Gehirnarealen könnte auf diese Weise frühzeitig Hinweise auf die Krankheit liefern. Mit Hilfe von markiertem löslichem β-Amyloid, das sich schnell in die β-Amyloid-Plaques (siehe unten) rekrutieren läßt, eröffnen sich ebenfalls neue Möglichkeiten der Bildgebung. – Neuropathologische Untersuchungen nach dem Tod der Erkrankten belegen eine Gehirnatrophie des Cortex (Großhirnrinde), besonders in den frontalen, temporalen und parietalen Bereichen ( siehe Abb. A ). Als Folge davon sind die inneren und äußeren Liquorräume erweitert. Am auffälligsten sind Einlagerung von Plaques (βA4-Amyloid-Plaques, Alzheimer-Plaques) im extrazellulären Raum sowie von veränderten Neurofibrillen innerhalb der Neuronen (neurofibrilläre "tangles", Alzheimer-Fibrillen). Hauptbestandteil der Plaques ( siehe Abb. B und C ) ist ein weitgehend unlösliches Peptid aus etwa 40 Aminosäuren, das sogenannte Aβ-Peptid (β-Amyloid-Peptid). Es entsteht bei der Prozessierung eines Vorläufers, des β-Amyloid-Vorläuferproteins (APP). Durch sogenannte Sekretasen werden verschieden lange Bruchstücke aus dem APP abgespalten; die β- und γ-Sekretasen setzen das Aβ-Peptid frei. Wahrscheinlich spielt eine gestörte Balance der einzelnen Sekretasen für die Ausbildung der Alzheimer-Krankheit eine zentrale Rolle. Im Zuge der Amyloidbildung aggregiert Aβ-Protein im extrazellulären Raum zu Plaques von ca. 0,2 mm Durchmesser – möglicherweise unter Beteiligung neurotoxischer freier Radikale. Für die Stabilität der Aggregate aus Aβ-Protein ist eine β-Faltblattstruktur ausschlaggebend, innerhalb des APP ist der Aβ-Bereich dagegen in Form einer Alpha-Helix gefaltet. Dieser Sachverhalt ist in neuester Zeit für einen therapeutischen Ansatz relevant geworden: Es hat sich gezeigt, daß die abgelagerten Fibrillen neurotoxische Wirkungen (Neurotoxine) besitzen. ERAB ist ein Eiweiß, welches Amyloid durch die Zellmembran transportieren kann und somit die intrazelluläre Toxizität erhöht. Eine Beeinflussung solcher Mechanismen könnte zu einer Verlangsamung des Fortschreitens der Krankheit führen. Cholesterin. – Bis 1998 wurden drei Gene beschrieben, die in mutierter Form die Alzheimer-Erkrankung verursachen können: Das APP-Gen auf Chromosom 21 und zwei als Präseniline bezeichnete Gene auf Chromosom 14 (Präsenilin 1) und Chromosom 1 (Präsenilin 2). Sogar eine Überexpression des normalen APP-Gens führt zur Alzheimer-Erkrankung: Patienten mit Trisomie 21 (Down-Syndrom), die ein überzähliges Chromosom 21 besitzen, entwickeln regelmäßig Morbus Alzheimer. Sechs Mutationen des APP-Gens sind bisher bekannt. Trotz ihrer Seltenheit war die Entdeckung dieser Mutationen wichtig, um den Beweis zu erbringen, daß APP kausal mit dem Morbus Alzheimer verknüpft ist: Jede dieser Mutationen führt zu einer Überproduktion von Aβ. Die dominant vererbbare Alzheimer-Erkrankung ist häufiger mit Mutationen auf dem Präsenilin-1-Gen assoziiert. Beide Präsenilin-Genprodukte gehören einer Familie von phylogenetisch alten integralen Membranproteinen an, über deren Funktion wenig bekannt ist. Nach Untersuchungen an Mäusen spielen sie für Entwicklungsvorgänge eine wichtige Rolle. Schaltet man sie aus, sterben die Embryonen in einer frühen Entwicklungsphase. Alle drei genannten Genprodukte beeinflussen in bisher nicht verstandener Weise die APP-Prozessierung und Kompartimentierung und sorgen, in mutierter Form, für eine vermehrte Bildung des Aβ-Peptids. Da sich "normal" alternde und Alzheimer-demente Personen in der Häufigkeit des Auftretens der Plaques nicht immer eindeutig unterscheiden, werden weitere pathogenetische Faktoren vermutet. Die intraneuronalen Neurofibrillenbündel als zweite Gruppe von Alzheimer-charakteristischen Gehirnstrukturveränderungen bestehen in der Hauptsache aus pathologisch veränderten Tau-Proteinen (τ-Proteine). Sie finden sich in aggregierter Form als Filamente im Cytoplasma der Nervenzellen ( siehe Abb. D und E ). Tau ist normalerweise für die Stabilität von Mikrotubuli verantwortlich. Das veränderte τ-Protein ist im Gegensatz zu der Normalform unlöslich, abnormal phosphoryliert und nicht an Mikrotubuli gebunden. Ob, wie bisher vermutet, die Phosphorylierung tatsächlich den aberranten τ-Proteinen eine besondere Festigkeit verleiht, ist neuerdings etwas fraglich geworden. Auch unverändertes τ-Protein kann nach Zugabe von Heparin oder Heparinsulfat im Reagenzglas zu helicalen Filamenten aggregieren. Bis 1998 wurde die pathogenetische Bedeutung von Tau mit dem Argument immer wieder in Frage gestellt, man habe keine Mutationen von Tau gefunden, welche zu dementiellen Erkrankungen führen – ganz im Gegensatz zu den Mutationen bei APP und bei den Präsenilinen. Dies hat sich in neuester Zeit grundlegend geändert: über 40 Mutationen im Tau-Gen wurden mit den "corticobasalen Demenzen" (die häufigsten Spielarten der vererbbaren Demenzen) im kausalen Zusammenhang gebracht. Im übrigen haben genetische Studien zwei weitere Risikofaktoren identifiziert. Im Vergleich zu Kontrollgruppen weisen Alzheimer-Patienten überdurchschnittlich häufig das ε4 Allel des Apolipoprotein E auf. Menschen, die ε4-homozygot sind, sind einem besonders hohen Alzheimer-Risiko ausgesetzt. Auch gewisse Mutationen im Alpha-2 Makroglobulin-Gen scheinen möglicherweise mit einem Alzheimer-Risiko einherzugehen. Ferner wird neuerdings auch ein möglicher Zusammenhang mit dem Bakterium Chlamydia pneumoniae diskutiert, das man im Gehirn von Alzheimerpatienten gefunden hat. – Es ist noch unklar, warum die Ablagerung von Aβ-Peptid und Tau zur Demenz führt. Von einigen Autoren wird die Auslösung der Alzheimer-Krankheit mit immunologischen Vorgängen, die durch Streß ausgelöst werden, in Verbindung gebracht (Neuroimmunologie, Psychoneuroimmunolgie; siehe Zusatzinfo ). In Alzheimer-Gehirnen findet man eine erhöhte Konzentration des Cytokins Interleukin 6 (Il-6; Interleukine), das zusammen mit anderen Cytokinen eine Akutphasenreaktion auslösen kann. Innerhalb der Plaques von Alzheimer-Kranken wurden erhöhte Konzentrationen von Akutphasenproteinen gefunden. Nach dieser Vorstellung synthetisieren Astrocyten und Mikrogliazellen, die immunkompetenten Zellen des Gehirns, Akutphasenproteine, unter anderem Proteasehemmer der α-APP-Sekretase, was zu einer Anreicherung des Aβ führt. In einer Placebo-kontrollierten Studie mit Indometacin, einem Antiphlogistikum, konnten das Fortschreiten der Krankheit im Anfangsstadium gebremst bzw. die Symptome leicht gemindert werden. – Wünschenswert wäre ein brauchbares Tiermodell, an dem sich die zahlreichen pathologischen Effekte reproduzieren ließen. Mit der Herstellung einer transgenen Maus ist man diesem Modell näher gekommen. Die Maus überexprimiert im Gehirn ein mutiertes APP-Gen, was zu massiven Amyloid-Ablagerungen und Nervenuntergängen führt. Im Cortex vermindert sich die Synapsendichte. Es wurde daraus geschlossen, daß die Plaques Ursache und nicht Folge der Krankheit sind. Allerdings kommt es nicht zur Ausprägung neurofibrillärer Bündel. – Therapieansätze können an diesem Modell erarbeitet werden, die darauf abzielen, die Amyloid-Ablagerung zu blockieren oder abgelagertes Amyloid zu mobilisieren. Bisherige Therapieansätze sind nur symptomatisch und umfassen z.B. die Gabe von Acetylcholin-Esterase-Hemmern, um den Untergang cholinerger Neuronen zu kompensieren ( siehe Tab. ). Des weiteren gibt es Versuche, die cholinerge Wirkung der restlichen Neuronen durch Injektion genetisch veränderter Fibroblasten, welche Cholin-Acetyl-Transferase exprimieren, zu verstärken. Entsprechende Versuche sind auch mit Nervenwachstumsfaktor produzierenden Fibroblasten durchgeführt worden. In diesen Fällen konnte in Tierversuchen der Untergang cholinerger Neuronen verhindert werden. Auch sollen Antioxidantien wie Vitamin E den Untergang neuronaler Zellen reduzieren können. 1998 ist es gelungen, die β-Faltblattstruktur des Amyloids in den Gehirnen von Ratten durch ein künstlich hergestelltes Peptid ("beta-sheet breaker") von nur fünf Aminosäuren zu stören und damit die Amyloidbildung zu verhindern bzw. schon vorhandenes Amyloid aufzulösen. Welche therapeutische Bedeutung dieser Entdeckung zukommt, bleibt abzuwarten.
K.G.C./A.A./G.H.
Lit.: Bauer, J.: Die Alzheimer-Krankheit. Neurobiologie, Psychosomatik, Diagnostik und Therapie. Stuttgart 1994. Becker, R , Giacobini, E. (Hrsg.): Alzheimer Disease: From Molecular Biology to Therapy. Basel 1997. Kosik, K.S., Christen, Y., Selkoe, D.J. (Hrsg.): Alzheimer's Disease: Lessons from Cell Biology. Berlin 1995. Krämer, G.: Alzheimer Krankheit. Ursachen, Krankheitszeichen, Untersuchung, Behandlung. 3Stuttgart 1996. Maurer, K., Ihl, R., Frölich, L.: Alzheimer. Grundlagen, Diagnostik, Therapie. Berlin 1993. Roses, A.D., Weisgraber, K.H., Christen, Y. (Hrsg.): Apolipoprotein E and Alzheimer's Disease. Berlin 1996. Weis, S., Weber, G.: Handbuch Morbus Alzheimer. Neurobiologie, Diagnose, Therapie. Weinheim 1997.
Ursachenforschung: Eine ungünstige Kombination verschiedener Gen-Allele scheint ein besonderer Risikofaktor für die sporadische Form der Alzheimer-Krankheit zu sein. Dabei spielt nach neueren Erkenntnissen das ε4-Allel des Apolipoproteins E eine wichtige Rolle. Apolipoprotein E wirkt im Cholesterinstoffwechsel mit und ist maßgeblich an der Extraktion des Cholesterins aus Zellen beteiligt; das ε4-Allel des Proteins jedoch scheint diese Aufgabe nicht mehr oder nur noch eingeschränkt erfüllen zu können. Dadurch reichert sich Cholesterin vermehrt in den Zellen (vor allem in Nervenzellen) an. Da hohe Cholesterinmengen jedoch vermehrt die Entstehung freier Radikale begünstigen, müssen sich die Nervenzellen vor diesen schützen; hier könnte nun das Amyloid-Vorläuferprotein ins Spiel kommen, welches vermutlich die Zellen vor den Radikalen schützt. Wird es jedoch in zu großen Mengen produziert, um den ebenfalls großen Mengen an freien Radikalen entgegenzuwirken, wird zuviel β-Amyloid-Peptid daraus abgespaltet: Die Alzheimer-Plaques bilden sich. – Während bei der early-onset Alzheimer-Krankheit verursachende Mutationen bereits lokalisiert wurden, waren solche bei der late-onset Alzheimer-Krankheit bisher nicht bekannt. Kürzlich wurden jedoch auch hierfür charakteristische Sequenzen auf Chromosom 10 entdeckt. – Es gibt auch erste Hinweise darauf, daß der Besitz des ε4-Allels einen Befall durch Chlamydia pneumoniae begünstigt und daß diese vermehrt in den Amyloid-Plaques auftauchen. Ob sie deren Entstehung (mit)verursachen ist jedoch noch unklar. – In eine andere Richtung wiederum deutet die Entdeckung, daß einige Nervenzellen im Gehirn von Alzheimer-Patienten anscheinend erfolglos versuchen, sich zu teilen: Sie treten in den Zellteilungszyklus ein und vermehren ihre Chromosomen, bilden dann aber doch keine neuen Zellen, so daß sie mit der doppelten Anzahl an Chromosomen zurückbleiben, was zum Untergang dieser Zellen führen könnte. Eine Spekulation ist, daß die für die Alzheimer-Krankheit typischen Ablagerungen die Ursache für einen Entzündungsprozeß im Gehirn sein könnten, welcher die Zellteilung stimulieren würde.
Therapie: Möglicherweise kann das β-Amyloid-Peptid, welches als Hauptursache der Alzheimer-Krankheit diskutiert wird, diese auch heilen. Injiziert man nämlich β-Amyloid-Peptid in transgene Mäuse mit vielen Amyloid-Plaques (Alzheimer-Modell), so bilden diese spezifische Antikörper, die offensichtlich auch die Blut-Hirn-Schranke überschreiten und im Gehirn abgelagerte Amyloid-Plaques abbauen können. Die immunisierten Tiere schneiden auch in Lern- und Gedächtnistests mit zunehmendem Alter deutlich besser ab als die transgenen Kontrollmäuse. Auf dieser Basis könnte vielleicht ein Impfstoff entwickelt werden, der die Krankheit nicht nur verlangsamen, sondern unter Umständen ganz heilen kann. – Am 5. April 2001 wurde zum ersten Mal beim Menschen eine Gentherapie gegen die Alzheimer-Krankheit durchgeführt. Hierbei wurden genetisch veränderte Zellen in das Gehirn einer 60-jährigen Alzheimer-Patientin verpflanzt. Die Zellen, die von der Haut der Patientin stammten, hatten vorher ein Gen erhalten, das für den Nervenwachstumsfaktor codiert. Dieser soll im Gehirn die Bildung neuer Nervenzellen anregen. Nicastrin.
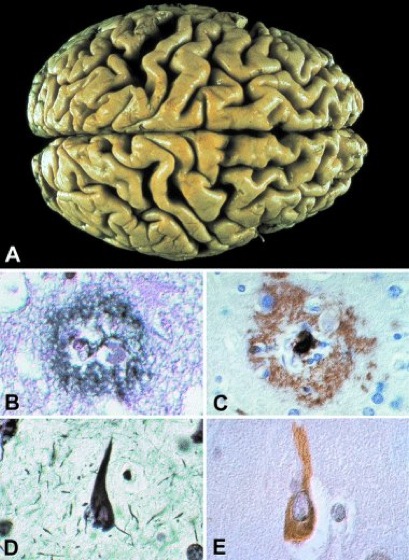
Alzheimer-Krankheit
neuropathologische Befunde:
A schwere Atrophie des Gehirns mit Verschmälerung der Gyri und Verbreiterung der Sulci
B neuritischer Plaque (Versilberungstechnik nach Bodian)
C immunhistochemischer Nachweis von Aβ-Peptid in den Amyloidablagerungen
D neurofibrillärer Tangle in Perikaryon und Dendriten einer Nervenzelle (Versilberungstechnik nach Bodian)
E immunhistochemischer Nachweis von Tau-Protein
Alzheimer-Krankheit
Alzheimer-Krankheit und Streß:
Da bei anderen chronischen Krankheiten, wie der rheumatoiden Arthritis oder der Psoriasis (Schuppenflechte), bei denen eine unkontrollierte Il-6-Produktion vorliegt, psychosomatische Komponenten eine wesentliche Rolle spielen, wird ein Zusammenhang zwischen psycho-physischem Streß und der gesteigerten Il-6-Produktion vermutet. In Tierexperimenten wurde dies bereits nachgewiesen. Bei Studien mit Alzheimer-Patienten, die vor dem 65. Lebensjahr erkrankten, war ein Großteil der Patienten lang anhaltenden Streßepisoden ausgesetzt, bevor die ersten Symptome der Krankheit auftraten.
Alzheimer-Krankheit
Überblick über aktuelle Substanzen zur Behandlung der Alzheimer-Krankheit
| ||
| Acetylcholin-Esterase-Hemmer (Tacrin, Donepezil, Rivastigmin u.a.) | Abbau von Acetylcholin wird gehemmt | |
| Ampakin | Glutamatrezeptoren werden stimuliert | |
| Androgene | Bildung von tangles wird gehemmt | |
| Antioxidantien | oxidativer Streß wird reduziert | |
| Entzündungshemmer | Aktivierung von Mikrogliazellen wird gehemmt | |
| Nervenwachstumsfaktor | Acetylcholinsynthese und Regeneration wird gefördert | |
| Nicotin | nicotinische Acetylcholinrezeptoren werden stimuliert | |
| Östrogene | cholinerge Aktivität, cerebrale Durchblutung und Glucosemetabolismus werden gefördert; Amyloid wird reduziert |
Schreiben Sie uns!