Lexikon der Chemie: Diels-Alder-Reaktion
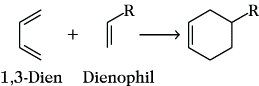
Diels-Alder-Reaktion, Diensynthese, eine von O. Diels und K. Alder 1928 erstmals beschriebene Methode der 1,4-Addition eines aktivierten Alkens oder Alkins an ein konjugiertes Dien unter Bildung eines sechsgliedrigen Ringsystems. Bei dieser in den meisten Fällen als synchrone (4 + 2)-Cycloaddition verlaufenden Reaktion werden 1,3-Diene und die aktivierten Alkene bzw. Alkine, die auch als Dienophile bezeichnet werden, unter Neubildung von zwei σ-Bindungen auf Kosten zweier π-Bindungen zusammengelagert. Wichtige Dienophile sind Maleinsäureanhydrid, Acrolein, Tetracyanoethylen, Acrylsäureester, p-Benzochinon, Acetylendicarbonsäureester und Azodicarbonsäureester. Als Dienkomponenten können aliphatische und alicyclische 1,3-Diene sowie verschiedene aromatische und heterocyclische Systeme eingesetzt werden, z. B. s-(Z)-Buta-1,3-dien, Cyclopenta-1,3-dien, Cyclohexa-1,3-dien, Anthracen und Furane. Außerdem können auch heteroanaloge 1,3-Diene bei der D. eingesetzt werden. Dabei handelt es sich um Verbindungen, in denen z. B. eine C=C-Doppelbindung durch eine C=O-, C=S- oder C=N-Gruppe ersetzt ist, z. B. α,β-ungesättigte Aldehyde und Ketone, α,β-ungesättigte Thioketone. Die D. verlaufen besonders leicht, wenn die Alkene bzw. Alkine durch Substituenten mit -I- oder -M-Effekt aktiviert sind und die Dienkomponenten +I- oder +M-Substituenten enthalten. Eine wichtige Voraussetzung für die D. ist außerdem die s-Z-Konformation des Diens. Die Spaltung der Diels-Alder-Addukte in die Ausgangskomponenten, die häufig bereits unter sehr milden Bedingungen beobachtet werden kann, wird als Retro-Diels-Alder-Reaktion bezeichnet; z. B. zerfällt das endo-Dicyclopentadien bei etwa 180 °C in Cyclopentadien. Die D. hat für die Konstitutionsaufklärung zahlreicher ungesättigter Naturstoffe sowie für die Synthesen einer Reihe von Insektiziden, z. B. Chlordan, Aldrin und Dieldrin, Bedeutung erlangt.
Schreiben Sie uns!