Lexikon der Biologie: nicotinische Acetylcholinrezeptor-Kanäle
nicotinische Acetylcholinrezeptor-Kanäle, Abk. nAChRK, nicotinische Acetylcholinrezeptoren, nicotinerge Acetylcholinrezeptoren, n-Cholinozeptor, ein Ionenkanal (intrinsisches Membranprotein), der aus 5 Untereinheiten besteht und sich nach Binden des Neurotransmitters Acetylcholin öffnet. Jede Untereinheit besteht aus 4 membrandurchspannenden Segmenten. Die Benennung dieses Acetylcholinrezeptor-Subtyps leitet sich von seinem selektiven Agonisten Nicotin ab. Neben diesem Subtyp gibt es noch den muscarinischen Acetylcholinrezeptor. Nicotinische ACh-Rezeptoren gehören zu den Klasse-I-Rezeptoren, den Liganden-gesteuerten Ionenkanälen. Die Bindungsstelle für den Transmitter bzw. Agonist und die Transmembranpore sind in einem Makromolekül zusammengefaßt. Aktivierung des nicotinischen Rezeptors führt mit kurzer zeitlicher Verzögerung (Latenz <5 ms) zum Öffnen der Kanalpore; er ist also ein Vermittler der schnellen synaptischen Übertragung. nAChRK haben große transmembranäre Poren (0,65 nm ×0,65 nm). Sie sind für eine Vielzahl von Kationen durchlässig und nicht permeabel für Anionen, gehören also zu den unselektiven Kationenkanälen. Von den physiologisch relevanten Kationen strömen nach Öffnen der Kanäle Na+ (Natrium) und Ca2+ (Calcium) entlang ihrem elektrochemischen Gradienten in das Zellinnere ein, K+ (Kalium) verläßt es. Die Kanäle des Skelett-Muskels zeigen dabei eine sehr geringe, die an Nervenzellen jedoch oft eine hohe Permeabilität für Ca2+. Netto resultiert ein in das Zellinnere gerichteter Ionenstrom, die Zelle depolarisiert (Depolarisation); der nAChRK ist also excitatorisch. Man findet ihn an erregbaren Zellen (z.B. zentrale, periphere sympathische und parasympathische Nervenzellen, Skelettmuskelzellen und sekretorische Zellen). In Muskeln werden über sie Endplattenpotentiale (erregendes postsynaptisches Potential) als Antwort auf neuronal freigesetztes Acetylcholin ausgelöst. Summierung dieser Endplattenpotentiale führt dann zur Entstehung von Muskel-Aktionspotentialen und letztendlich zur Muskelkontraktion. – Der muskuläre nAChRK der motorischen Endplatte ist aus 2 α-, 1 β-, 1 γ- und 1 δ- Untereinheit zusammengesetzt ( ä vgl. Abb. ). Die neuronalen nAChRK sind nur aus α- und β-Untereinheiten zusammengesetzt, wobei insgesamt 8 verschiedene α-Untereinheiten und 3 verschiedene β-Untereinheiten bekannt sind. Die neuronalen nAChRK kommen in unterschiedlichen Kombinationen aus 1, 2, 3 oder 4 verschiedenen Untereinheiten vor. 2 Schlangengifte aus dem Gift der malayischen Bungars (Bungarus multicinctus) können als pharmakologisches Werkzeug zur Unterscheidung zwischen beiden Typen benutzt werden. Jeweils in nanomolaren Konzentrationen blockiert das α-Bungarotoxin selektiv muskuläre, das κ-Bungarotoxin selektiv viele neuronale nAChRK (Bungarotoxine). Alle nAChRK besitzen 2 Bindungsstellen für Acetylcholin, die zum Teil auf den α-Untereinheiten lokalisiert sind. nAChRK desensibilisieren in fortgesetzter Gegenwart von Acetylcholin binnen einiger Sekunden, d.h., sie schließen und gewinnen ihre Sensitivität gegenüber Acetylcholin erst nach einigen Sekunden bis Minuten, nachdem der Agonist entfernt wurde, wieder zurück. Der größte Teil der Informationen über die Struktur des nAChR stammt vom elektrischen Organ des Zitterrochens (Torpedo). Dieses besteht aus modifizierten Muskelzellen mit einer sehr hohen Dichte an nAChRK. Chromosomenkarte ( Chromosomenkarte I
Chromosomenkarte II
Chromosomenkarte III
Chromosomenkarte IV
).
W.N./S.L.
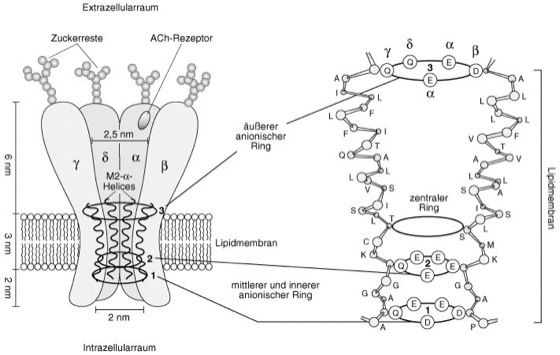
nicotinische Acetylcholinrezeptor-Kanäle
Strukturmodell des nicotinischen Acetylcholin-Rezeptors:
Auf der linken Seite ist das Modell des Pentamers, bestehend aus α-, β-, γ- und δ-Untereinheiten, aus dem elektrischen Organ des Zitterrochens dargestellt. Eine der beiden α-Untereinheiten ist nicht abgebildet. Der extrazelluläre Teil des Kanals bildet einen trichterförmigen Eingang, der sich innerhalb der Lipidmembran verengt (0,65 nm ×0,65 nm). Jede Polypeptidkette der einzelnen Moleküluntereinheiten besteht aus 4 transmembranären Segmenten (M1–M4). Wahrscheinlich begrenzt jeweils das Transmembransegment M2 der 5 Untereinheiten die Pore wie eingezeichnet. M2 bildet dabei die räumliche Struktur einer α-Helix, wie auf der rechten Seite der Abb. für die M2-Segmente der β- und γ-Untereinheit gezeigt wird. Eine ähnliche α-helicale Struktur findet sich auch bei bakteriellen Proteinen (z.B. Bakteriorhodopsin).
Die α-Helices von M2 der 5 Untereinheiten des Kanals zeigen in ihrer räumlichen Struktur einen Knick in das Innere der Pore und verlegen sie so in Abwesenheit von Agonisten wie Acetylcholin oder Nicotin. Nach Binden eines Agonisten kommt es dann zur Auswärtsrotation des Knicks, und Kationen können durch die Pore fließen. Die Selektivität des Ionenkanals für Kationen beruht auf negativ geladenen hydrophilen Aminosäureseitenketten, die zur Pore hin weisen, während hydrophobe Aminosäuren ihre Reste zur Lipidschicht orientieren. Diese negativen Seitenketten von jeder der 5 Untereinheiten des Rezeptors ergänzen sich zu 3 Ladungsringen an der Porenwand (1, 2, 3), die die Durchtrittsstelle für die Kationen markieren. Wenn ein Ion den Kanal passiert, trifft es auf diese 3 negativ geladenen Ringe, von denen der äußere und innere möglicherweise als Vorfilter dienen, während der mittlere Ring vermutlich als eigentlicher Selektivitätsfilter für die Kationen fungiert. Ein zusätzlicher Ring (zentraler Ring) wird durch ungeladene polare Aminosäurereste gebildet. Der anionische mittlere Ring und der zentrale Ring formen zusammen einen kurzen engen Abschnitt der Kanalpore. Einen ähnlichen Aufbau aus unterschiedlichen, wenn auch homologen Proteinuntereinheiten zeigen auch andere Mitglieder der Klasse der Liganden-gesteuerten Ionenkanäle, wie Glutamat- (Glutamatrezeptor-Kanäle), Serotonin- (Serotoninrezeptor-Kanäle), GABA- (GABA-Rezeptor-Kanäle) und Glycin-aktivierte Rezeptorkanäle (Glycinrezeptor-Kanäle).
Abk.: A Alanin, C Cystein, D Aspartat, E Glutamat, F Phenylalanin, G Glycin, I Isoleucin, K Lysin, L Leucin, M Methionin, P Prolin, Q Glutamin, S Serin, T Threonin, V Valin.
Schreiben Sie uns!